ハイライト
- 汎発性アカンソーシス・ニグリカンス(AN)と肺病変を伴う特異な症候群の原因として、胚細胞および体細胞L858R EGFR変異体を同定。
- 主な臨床特徴には、早期発症の屈曲部皮膚肥厚、眼周囲色素沈着、羊毛状毛髪、掌蹠角化症がある。
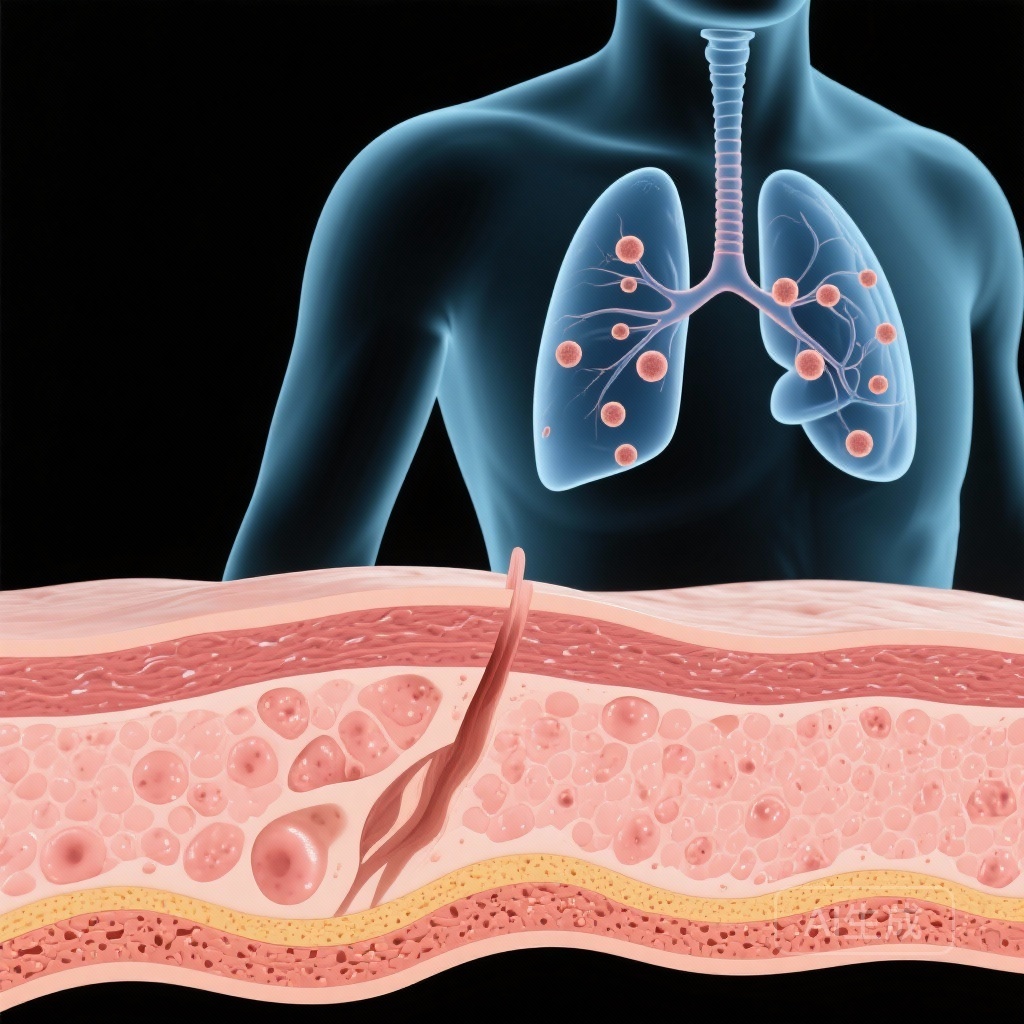
- 影響を受けた個体において肺結節が検出され、これは肺腺癌の潜在的な前駆病変である。
- EGFRチロシンキナーゼ阻害剤(TKI)による全身治療により、皮膚および肺症状がほぼ完全に改善。
背景
アカンソーシス・ニグリカンス(AN)は、通常、インスリン抵抗性、肥満、内分泌障害と関連する一般的な皮膚科的マーカーです。しかし、ANが幼少期に早期発症し、汎発性である場合、または高血糖症のない場合は、基礎となる遺伝的症候群や内臓悪性腫瘍を示す可能性があります。上皮成長因子受容体(EGFR)の機能獲得変異体は、非小細胞肺がん(NSCLC)の主要なドライバーとしてよく知られていますが、全身性の症候性皮膚疾患を引き起こす役割については最近まで不明でした。
EGFR経路は、角質形成細胞の増殖と分化に重要です。体細胞変異によるこの経路の過活性化はがん発生の特徴ですが、特にエクソン21のL858R置換を伴う新規胚細胞変異は、独自の臨床的課題を提示します。本研究では、重症で早期発症の症候性ANの遺伝的基盤を調査し、EGFR阻害剤を使用した病態指向治療の治療的ポテンシャルを探ります。
研究デザイン
この症例シリーズ研究は、重度の皮膚肥厚と色素沈着を特徴とする3人の参加者を対象としました。2人は正常血糖値と早期発症の眼周囲色素沈着を呈し、進行して汎発性の屈曲部皮膚肥厚を示しました。3人目は、広範囲の表皮ネボスで当初診断されました。参加者の年齢は8歳から18歳でした。
研究チームは、疾患を特徴付けるために多面的なアプローチを採用しました:
-
遺伝子解析:
全外因子配列解析(WES)を血液および皮膚サンプルで実施し、病原性変異体を同定。
-
分子検証:
影響を受けた皮膚組織と培養角質形成細胞を用いてEGFR経路の活性化を評価し、MAPKなどの下流シグナル分子に焦点を当てました。
-
臨床評価:
参加者は包括的な肺機能テストと高解像度の肺画像(CTスキャン)を実施し、全身性の関与をスクリーニング。
-
治療介入:
本研究では、これらの患者の全身EGFR阻害剤治療への臨床反応をモニタリングし、皮膚の質感と肺結節の負荷の変化を評価しました。
主要な結果
ゲノムおよび分子ドライバー
3人の参加者はすべてEGFR L858R変異体を有していました。汎発性皮膚関与の2つの症例では、変異体は新規胚細胞であり、局所化した表皮ネボスを呈する個体では体細胞モザイク変異体が見られました。病変皮膚と培養角質形成細胞の分析により、EGFR経路の活動が著しく増加していることが確認されました。in vitro薬理学的阻害により、この過活性化が成功裏に抑制され、全身治療の根拠が提供されました。
現象的表現
胚細胞症例の臨床表現は非常に一貫していました。主な特徴には以下の通りです:
- 屈曲部位(腋窩、首、腹股溝)での顕著な強調を伴う汎発性獲得性角化症。
- 羊毛状毛髪と掌蹠角化症。
- 早期発症の眼周囲色素沈着。
重要なのは、本研究が著しい肺関与を特定したことである。肺画像では、参加者に複数の肺結節が確認されました。L858R変異体は肺腺癌の既知のドライバーであり、これらの結節は前駆病変とみなされ、これらの若年患者が生涯で肺悪性腫瘍に罹患するリスクが非常に高いことを示唆しています。
EGFR阻害の治療効果
分子発見から臨床応用への移行は劇的な結果をもたらしました。全身EGFR阻害剤(エルロチニブやゲフィチニブなど)を投与された患者では、皮膚疾患が有意に回帰しました。さらに、フォローアップ画像では、肺結節の数と大きさの解決または大幅な減少が示され、TKIがこの患者集団における治療薬および予防薬として機能することが示唆されました。
専門家のコメント
本研究は、EGFRシグナルと皮膚生理学の関係に対する理解を再定義しています。臨床医学の文脈では、「EGFR-AN症候群」の同定は、小児皮膚科医と腫瘍科医にとって重要な診断枠組みを提供します。正常な糖代謝を持つ患者で汎発性ANが観察された場合、EGFR変異体の遺伝子スクリーニングを必須と考えるべきです。
L858R変異体と観察された現象との機序的リンクは生物学的に説明可能である。EGFRシグナルは、棘層の拡大を促進し、最終分化を阻害することで、皮膚の過角化とアカントーシスを引き起こします。肺では、同じ変異が肺胞上皮細胞のクローナル拡大を促進し、結節形成を引き起こします。本研究におけるTKI療法の成功は、精密医療の力を示しています。具体的な分子ドライバーを標的とすることで、医師は可視化可能な皮膚疾患だけでなく、生命を脅かす肺前駆病変も治療できます。
結論
江等の研究は、新規胚細胞L858R EGFR変異体が汎発性アカンソーシス・ニグリカンスと肺疾患の高リスクを特徴とする多系統症候群を引き起こすことを確立しています。この発見は、重症ANの診断パラダイムを代謝中心からゲノム中心にシフトさせます。早期認識は不可欠であり、EGFR標的療法の開始を可能にし、皮膚症状の逆転と肺結節の進行を侵襲性腺癌に至らせる可能性のある予防を可能にします。長期的な追跡研究が必要であり、最適なTKI療法の期間とこれらの個体の長期予後を決定する必要があります。
参考文献
江X, ジェンGMY, ヤンZ, 他. 新規胚細胞L858R EGFR変異体と汎発性アカンソーシス・ニグリカンス. JAMA Dermatol. 2026年1月14日オンライン公開. doi:10.1001/jamadermatol.2025.5414