ハイライト
- 静止状態fMRIから得られる機能的接続性は、非定型アルツハイマー病(AD)変異体の横断的タウ負荷と縦断的タウ蓄積を強力に予測します。
- 異なるタウ-PET中心点が臨床的表現型に対応しています:後頭皮質萎縮症(PCA)では視覚ネットワーク、ロゴペニック型進行性失語症(lvPPA)では言語ネットワーク、行動変異型AD(bvAD)や皮質基底核症候群AD(CBS-AD)では他の関連ネットワークです。
- 死後タウ病理学分析は、生体PET所見を裏付け、接続性をガイドとするタウ伝播が非定型AD表現の全般にわたる普遍的なメカニズムであることを強調しています。
- これらの知見は、ADにおけるタウ障害を対象とした臨床試験のためのパーソナライズされたバイオマーカーと被験者固有のエンドポイントの開発を支援します。
背景
アルツハイマー病(AD)は、アミロイド-β斑とタウ神経原線維もつれの進行的な蓄積を特徴とし、これらは神経変性と臨床症状との相関がより強いことが知られています。典型的なADは主に海馬回を介して記憶に影響を与え、タウの広がりパターンがよく特徴づけられています。しかし、後頭皮質萎縮症(PCA)、ロゴペニック型進行性失語症(lvPPA)、行動変異型AD(bvAD)、皮質基底核症候群AD(CBS-AD)などの非定型AD変異体は、異なる臨床的表現型と空間的なタウ沈着パターンを呈します。これらの異質な形態におけるタウ伝播を導く基礎メカニズムを理解することは、診断と治療の進歩にとって重要です。
以前の研究では、タウが機能的に接続されたネットワークに沿って神経細胞間で広がるというモデルが主に典型的なADで説明されてきました。しかし、非定型AD形態においてこの接続性ベースのモデルが一般化するかどうかは、その独自のタウ分布と臨床的表現のため不明でした。
主要な内容
研究設計と対象者
de Bruinらによる画期的な多施設研究は、14の国際サイトで収集された320人の非定型ADサブタイプの臨床診断を受けた被験者(PCA 139人、lvPPA 103人、bvAD 35人、CBS-AD 43人)のデータを組み込みました。78人の被験者には縦断的タウ-PET画像が利用可能で、これによりタウ伝播の時間的推論が強化されました。また、93人の非定型AD患者を対象とした独立した死後コホートが病理学的検証を提供しました。
方法論の進歩
複数のタウ-PETトレーサーは、ガウス混合モデルを使用して標準化吸収値比(SUVRs)を0%から100%までのタウ陽性確率に変換することにより、一貫性のある評価が可能になりました。アルツハイマー病神経画像イニシアチブ(ADNI)の健康高齢者コホートからの静止状態機能MRI(rs-fMRI)接続性パターンが規範的な接続性スcaffoldとして使用されました。
線形回帰分析により、脳領域の機能的接続性の強さに対するタウ負荷と蓄積の共分散が評価されました。特に、各臨床変異体のタウ-PET中心点(基線タウ負荷の上位5%の領域)と蓄積中心点(タウ蓄積率の上位5%の領域)が特定され、伝播軌跡が地図化されました。
タウ中心点と臨床的表現型
– PCA-ADは、視覚ネットワークに集中したタウ中心点を示し、視空間障害の顕著な特徴を説明しています。
– lvPPA-ADは、言語ネットワークに一致する左半球の時間優位性を示し、失語症の特徴と一致しています。
– bvADとCBS-ADのパターンは、それぞれ前頭葉と運動関連領域を強調しています。
これらの地域の特化は、臨床的異質性を支え、タウ中心点が変異体固有の脆弱性に対応することを検証しています。
Figure 1. Tau-PET epicentres and positivity across AD variants.
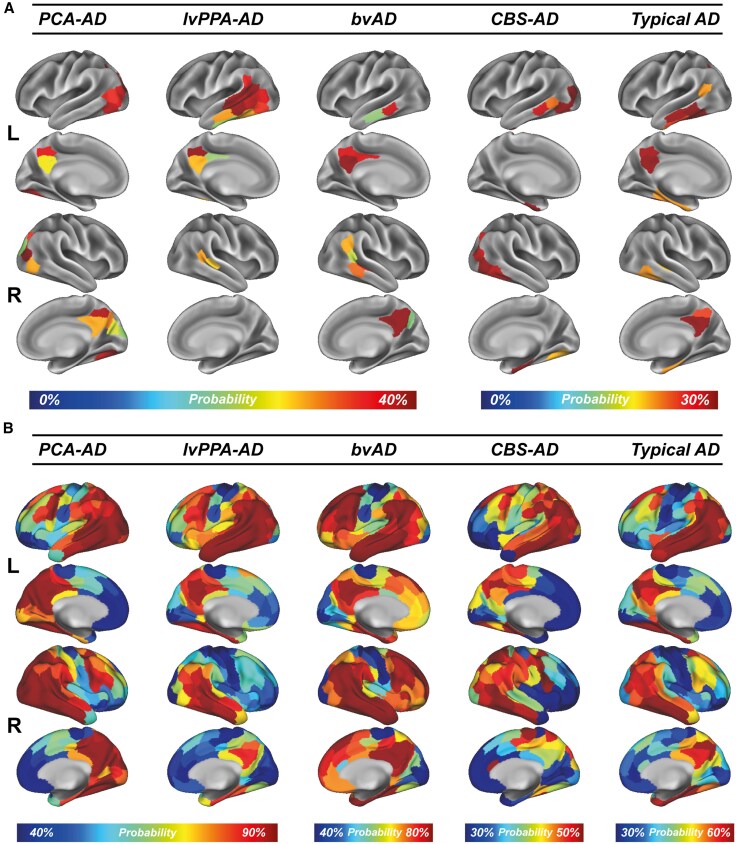
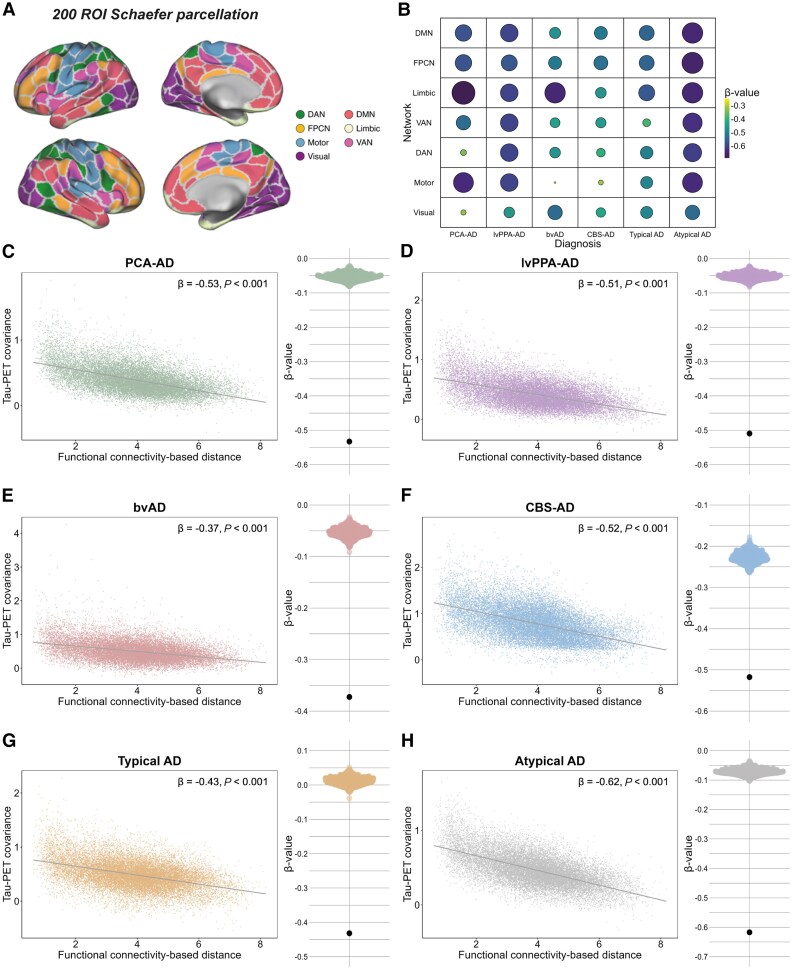
Figure 2. Association between functional connectivity and covariance in tau-PET across variants of AD.
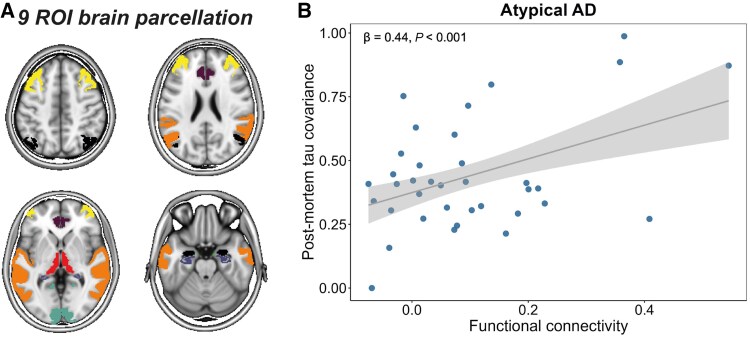
Figure 3. Association between functional connectivity and covariance in post-mortem tau pathology in atypical AD.
接続性がタウの広がりを予測
解析結果は、タウ中心点と機能的に強く接続している脳領域が、横断的および時間的により多くのタウ蓄積を示すことを明らかにしました。これは、死後のタウ負荷との比較でも確認され、生体画像結果を補完しています。
機能的に近い領域は、高いタウ陽性確率と蓄積率を示し、機能的に遠い領域は比較的保存されていました。これらの知見は、脳の内在的な接続性構造に従ってシナプス間でタウが広がるというモデルを支持しています。
個別化医療と試験への影響
各臨床表現型に固有のタウ伝播経路を特定することで、この接続性ベースのフレームワークは診断と進行のモニタリングの個別化に堅牢なメカニズム的な基礎を提供します。タウ-PET中心点と接続性プロファイルは、タウの広がりを阻止することを目指す治療試験における被験者選択とカスタマイズされたエンドポイントに情報を提供できます。
専門家のコメント
この研究は、接続性駆動のタウ伝播仮説が典型的なADを超えて複数の非定型変異体にも一般化されることを実証し、分野を大幅に進展させました。調和化されたタウ-PET指標の使用と縦断的・死後データの統合により、これらの知見に対する信頼性が向上しています。
メカニズム的には、機能的ネットワークに沿った選好的なタウの広がりが、臨床的表現を反映する神経病理学的基盤を提供し、選択的なネットワーク脆弱性を反映しています。これにより、今後のバイオマーカー開発と治療標的化におけるネットワークベースのフレームワークの重要性が強調されます。
制限点には、観察的研究であることによる因果関係の推論の困難さと、規範的な接続性データに依存していること(患者特異的なコネクトームとは異なる可能性がある)が含まれます。また、一次的なタウ伝播と二次的な神経変性過程を区別することも困難です。
それでも、機能的接続性の評価を臨床評価と試験デザインに組み込むことが提唱され、被験者固有のタウ進行モデルに向けた移行が推奨されています。
結論
包括的な多施設調査は、機能的接続性が非定型AD変異体におけるタウ病変の空間的および時間的軌道を普遍的に予測することを示しています。この接続性スcaffoldは、臨床的表現型を定義する中心点から機能的に接続された領域へとタウが広がることを支配し、臨床的表現と密接に一致しています。
このパラダイムの転換は、タウ病変の伝播に対する理解を洗練し、ADにおける精密な層別化と個別化介入を可能にします。患者由来の接続性測定と多様なバイオマーカーを統合した今後の研究が、これらの知見を臨床実践と効果的な疾患修飾療法に翻訳するために重要となります。
参考文献
- de Bruin H, Groot C, Barthel H, et al. Connectivity as a universal predictor of tau progression in atypical Alzheimer’s disease. Brain. 2025;148(11):3893-3912. doi:10.1093/brain/awaf279 IF: 11.7 Q1 . PMID: 40810361 IF: 11.7 Q1 ; PMCID: PMC12588720 IF: 11.7 Q1 .
- Brier MR, Gordon B, Friedrichsen K, et al. Tau pathology and functional connectivity correspond to clinical symptoms in Alzheimer disease. Neurology. 2016;87(19):1967-1974. doi:10.1212/WNL.0000000000003269 IF: 8.5 Q1 .
- Jones DT, Graff-Radford J, Lowe VJ, et al. Tau, amyloid, and cascading network failure across the Alzheimer’s disease spectrum. Cortex. 2017;97:143-159. doi:10.1016/j.cortex.2017.08.022 IF: 3.3 Q1 .
- Whitwell JL, Jack CR Jr, Boeve BF, et al. Imaging correlates of posterior cortical atrophy. Neurobiol Aging. 2007;28(7):1051-1061. doi:10.1016/j.neurobiolaging.2006.06.018 IF: 3.5 Q2 .