ハイライト
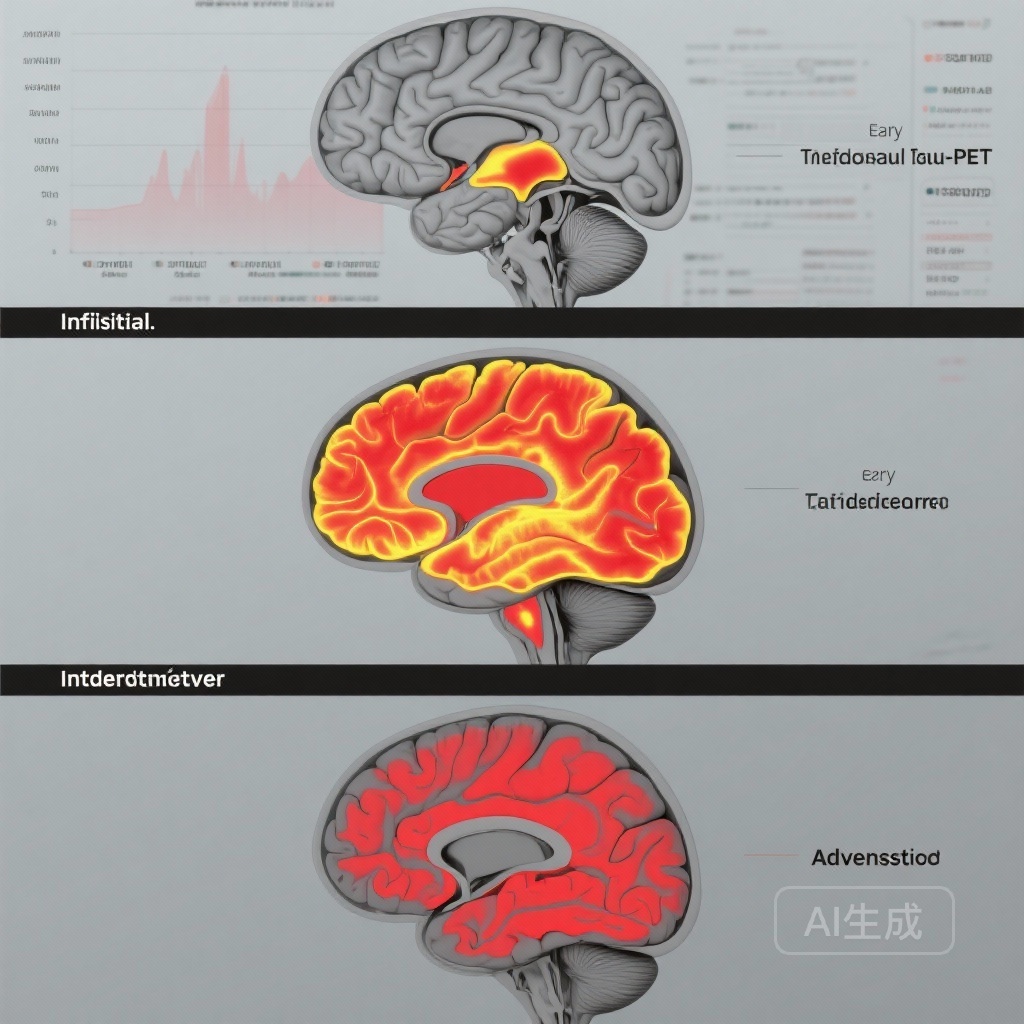
– 縦断的なタウ-PET蓄積は段階依存的です:初期(A+T2-)では最小限の変化、早期段階では局所的な増加、中間および進行段階では徐々に広範囲な蓄積が見られます。
– 基線での生物学的AD段階(A+/T段階)は、2つの独立したコホート(TRIADとADNI)で、その後のタウ拡散の地域分布と程度を予測しました。
– 疾患段階に合わせたアウトカムのROIを選択することで、仮想的な疾患修飾効果の試験サンプルサイズを30%~93%削減することができました。
背景
アルツハイマー病(AD)は、臨床症状だけでなく、アミロイド-β(A)とタウ(T)病理、神経変性(N)の生体内バイオマーカーによって定義される生物学的連続体として捉えられるようになっています。NIA-AA研究フレームワークはこのアプローチを公式化し、試験参加者の募集と層別化をバイオマーカーで定義された疾患段階に基づき、標的生物学と段階特異的病理を反映するバイオマーカーアウトカムを選択することを可能にしました(Jack et al., 2018)。タウ陽電子放出断層撮影(タウ-PET)は現在、疾患の生物学的段階付けと、抗タウまたは抗アミロイド介入の候補薬動態アウトカムとして広く使用されています。しかし、生物学的AD段階間のタウ-PET蓄積の縦断的パターンや、これらのパターンがROI選択と試験のサンプルサイズ計画にどのように影響するかについて、大規模でよく特徴づけられたコホートで完全に定量されていません。
研究デザイン
Trudelらは、Translational Biomarkers in Aging and Dementia (TRIAD)スタディとAlzheimer’s Disease Neuroimaging Initiative (ADNI)の2つの観察コホートから参加者を抽出し、後方視的縦断分析を行いました。参加者は基線時にアミロイド-PETとタウ-PET画像を撮影し、平均約3年間(±1.35年)追跡されました。生物学的AD段階は、アミロイド陽性の個人に対して、タウ-PETに基づく分類法を使用して適用されました:A+T2-(初期)、A+T2MTL+(早期;内側側頭葉タウ)、A+T2MOD+(中間期;より広範な側頭頂葉関与)、A+T2HIGH+(進行期;広範な新皮質タウ)。アミロイド-PET陰性の参加者は非ADコントロールとして機能しました。主要な分析では、線形混合効果モデルを使用して、段階別の縦断的地域タウ-PET変化を推定しました。二次分析には、ROIが基線段階に一致する場合と一致しない場合の、仮想的な疾患修飾効果を検出するために必要な参加者数を推定するための統計的検出力とサンプルサイズのシミュレーションが含まれました。
主要な知見
対象集団:プール分析には542人の参加者(平均年齢67.9±15.3歳、女性56.3%)が含まれ、そのうち321人が非ADコントロール、221人がバイオマーカーで定義されたAD症例でした。
段階がタウ蓄積の分布と速度を決定
主な知見は、基線タウ段階が時間とともにタウ-PET信号がどの地域でどれだけ速く増加するかを予測したことです。具体的には:
- A+T2-(初期)の個体では、4〜6年間有意義な縦断的タウ蓄積は観察されませんでした。これは、アミロイド陽性だがタウ陰性の個体では、PETで検出可能なタウの可視化が閾値レベルを超える前に長期間の潜伏期があることを示しています。
- 早期段階(A+T2MTL+)の参加者は、早期に影響を受ける地域に限定されたタウ蓄積を示しました(TRIAD:β = 0.15, 95% CI 0.09–0.21, p < 0.001;ADNI:β = 0.21, 95% CI 0.03–0.40, p = 0.03)。これは、線条体と内側側頭構造の進行に関与していることを示しています。
- 中間段階(A+T2MOD+)の参加者は、中間分布地域での蓄積を示しました(TRIAD:β = 0.16, 95% CI 0.10–0.22, p < 0.001;ADNI:β = 0.37, 95% CI 0.15–0.59, p = 0.001)。これは、内側側頭葉を越えて側頭頂葉への拡散を示しています。
- 進行段階(A+T2HIGH+)の参加者は、後期に影響を受ける新皮質地域での最大かつ最も広範な増加を示しました(TRIAD:β = 0.45, 95% CI 0.39–0.50, p < 0.001;ADNI:β = 0.31, 95% CI 0.14–0.49, p < 0.001)。
ROI選択と試験効率への影響
統計的検出力のシミュレーションでは、基線段階に基づいてタウ-PET ROIを選択することが、仮想的な疾患修飾効果を検出するために必要なサンプルサイズを大幅に削減することが示されました。報告された削減は、段階とコホートによって30%から93%まで異なりました。最大の利点は、既に広範な基線タウを示している集団で、進行段階のROIを使用した場合に見られました。これは、基線信号と動的範囲が最大である状況です。
コホート間の再現性
知見は、トレーサー、取得プロトコル、参加者の人口統計学的な違いにもかかわらず、独立したTRIADとADNIコホート間で一貫していました。これは、段階依存的なタウ動態の汎用性を支持しています。ただし、著者らは、トレーサーの多様性とコホートの構成がクロススタディの調和性の主要な制限要因であることを指摘しています。
専門家コメント
これらの結果は、AD試験の実践的な原則を検証しています:参加者の選択とアウトカムの測定を支配的な生物学に合わせることです。タウ標的治療薬の場合、適切なタウ段階の参加者を登録することは重要です。早期または前タウ段階(A+T2-)では、タウ-PET変化を主要アウトカムとする試験は、数年にわたってPETで検出可能な変化がほとんどないため、検出力が不足する可能性があります。一方、中間または進行段階の参加者は、測定可能な縦断的変化と大きな統計的信号を提供しますが、すでに進行した神経変性が確立されている場合は、疾患修飾介入が困難になる可能性があります。
メカニズムの観点から、ここでの段階依存的なタウの伝播は、タウ病理が前帯状/帯状皮質から始まり、線条体と新皮質領域に広がるという神経病理学的なBraak段階(Braak & Braak, 1991)を反映しています。PETを用いた段階付けは、この神経病理学的なカスケードを生体内で操作化し、標的とした試験デザインを可能にします。
考慮すべき制限点:本研究は後方視的かつ観察的なものであり、治療介入の因果推論はできません。PETトレーサー、画像処理、人口統計学的構成、コホート間のフォローアップ期間の違いにより、効果推定に不均一性が導入される可能性があります。最後に、タウ-PETの定量には技術的な留意点(一部のリガンドの非標的結合、部分体積効果)があり、変化の感度に影響を与える可能性があります。
臨床と試験デザインへの影響
疾患修飾試験を計画するスポンサーと研究者にとって、実践的な教訓は以下の通りです:
- スクリーニング時にバイオマーカー段階(A/Tフレームワーク)を使用し、登録された参加者が選択されたアウトカムに適切なタウ負荷と予想される動的範囲を持っていることを確認します。A+T2-の集団では、期待される効果サイズが大きくない限り、長期フォローアップがない限り、タウ-PETを縦断的アウトカムとして使用しないようにします。
- 基線段階に合わせたROI(例えば、早期段階の参加者には内側側頭ROI、中間/進行段階の参加者には側頭頂葉または全体的新皮質ROI)を選択して、検出力を最大化し、サンプルサイズとコストを削減します。
- 早期段階を対象とする場合、PETで検出可能なタウが蓄積する前に変化する可能性のある補完的な信号を捉えるために、バイオマーカーのアウトカム(タウ-PETに加えて流体マーカーや構造MRI)を組み合わせます。
- 可能な限り、サイト間で調和されたイメージングプロトコルとトレーサーの使用を事前に指定し、複数のトレーサーが必要な場合は、検証済みのクロストレーサー標準化手法を適用します。
結論
Trudelらは、生物学的に定義されたADにおけるタウ-PET蓄積が強く段階依存的であるという堅固な縦断的証拠を提供しました。基線A/Tベースの段階付けは、その後のタウ拡散の地域パターンと速度を予測し、アウトカムのROIを疾患段階に合わせることで、試験効率が実質的に向上します。これらの知見は、試験スクリーニング中に生物学的段階付けをルーチンで適用し、AD治療開発におけるイメージングエンドポイントの慎重な、段階に合わせた選択を主張しています。
資金提供とclinicaltrials.gov
主な資金提供とコホートごとのサポート詳細は、原著記事(Trudel et al., Neurology 2025)に報告されています。ADNIは、NIHの複数の助成金と産業界からの支援を受けている公的・民間パートナーシップです。TRIADは、コホート文書に記載されているように、機関と助成金の支援を受けています。この後方視的観察分析には、clinicaltrials.govの識別子は適用されません。
参考文献
Trudel L, Therriault J, Macedo AC, Servaes S, Hosseini SA, Bezgin G, Aumont E, Rahmouni N, Fernandez Arias J, Zheng Y, Wang YT, Chan T, Hall BJ, Hopewell R, Hsiao CH, Ferreira PCL, Bellaver B, Vitali P, Soucy JP, Pascoal TA, Gauthier S, Rosa-Neto P; Alzheimer’s Disease Neuroimaging Initiative. Implication for Clinical Trials From Longitudinal Tau-PET Accumulation Across Biological Alzheimer Disease Stages. Neurology. 2025 Oct 21;105(8):e214111. doi: 10.1212/WNL.0000000000214111. PMID: 40986433; PMCID: PMC12459282.
Jack CR Jr, Bennett DA, Blennow K, Carrillo MC, Dunn B, Haeberlein SB, Holtzman DM, Jagust W, Jessen F, Karlawish J, et al. NIA-AA Research Framework: Toward a biological definition of Alzheimer’s disease. Alzheimers Dement. 2018 Apr;14(4):535-562. doi: 10.1016/j.jalz.2018.02.018.
Braak H, Braak E. Neuropathological stageing of Alzheimer-related changes. Acta Neuropathol. 1991;82(4):239–259. doi:10.1007/BF00308809.