序論と背景
胃がんは依然として世界のがんによる死亡の主要原因の一つであり、特に東アジア、南米の一部、中央アジアに集中しています。2025年、「第二回台北グローバルコンセンサス」(Gut 2025; Liouら)は、ヘリコバクター・ピロリ(H. pylori)のスクリーニングと除菌を一次予防戦略として導入すべきか、またどのように導入すべきかを再検討しました。この更新は、最初の台北声明(2020年)以降の重要な新しいエビデンスに対応するものです。これには、2つの非常に大規模なコミュニティ試験(JAMA 2024; Nat Med 2024)、除菌療法の進歩(ビスマス製剤4剤併用療法およびカリウムイオン競合型アシッドブロッカー[P-CAB]ベースのレジメン)、および長期安全性(マイクロバイオーム、薬剤耐性、食道への影響)に関する新しいデータが含まれます。
本稿は、台北グローバルコンセンサスIIの核となる推奨事項とエビデンスを統合し、以前のガイダンスとの変更点を強調し、コンセンサスを臨床医、公衆衛生計画者、研究者のための実用的なアプローチに転換するものです。
新ガイドラインのハイライト
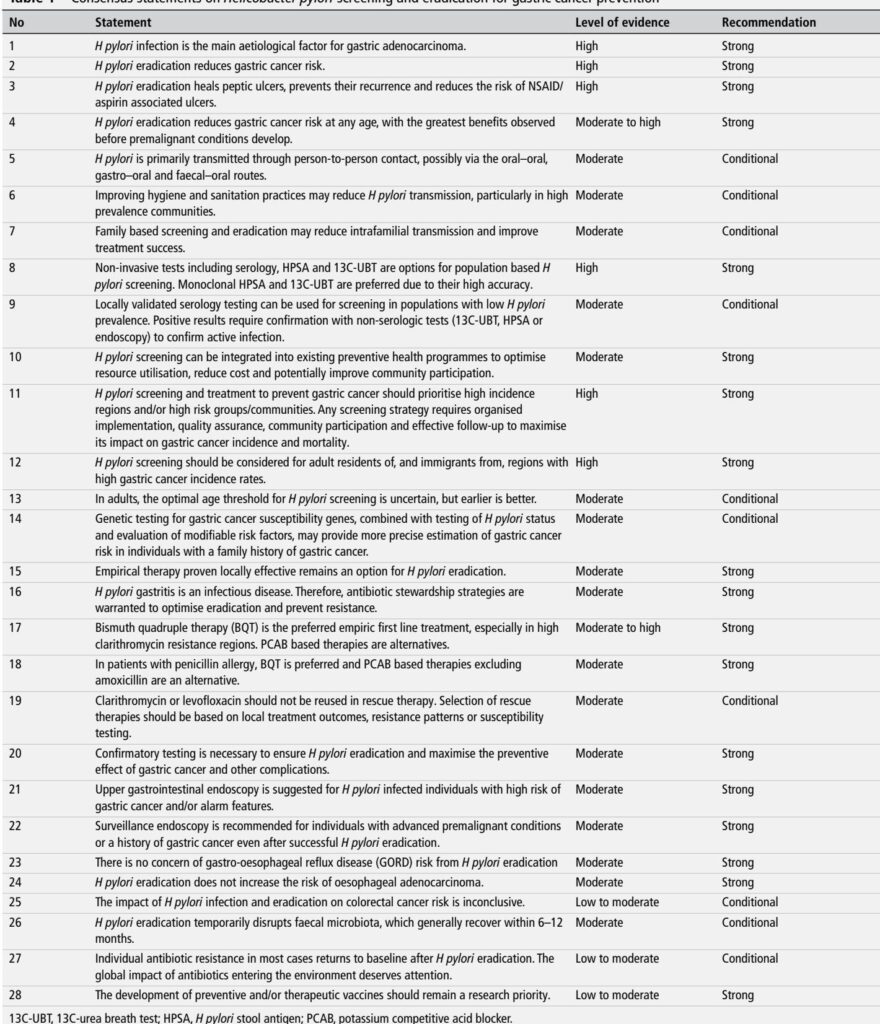
- コンセンサスの範囲: 12カ国から32名の専門家が参加。デルファイ法を用い、GRADEアプローチを使用して28のコンセンサス声明を作成。(Liou JMら、Gut 2025)。
- 全体的結論: ピロリ菌除菌は胃がんリスクを低減するため、すべての感染成人、特に除菌前に前がん病変が発生していない場合に提供されるべきである(強く推奨、エビデンスレベル高~中)。
- スクリーニングの焦点: 高発生地域および高リスク集団(胃がん高発生率地域の住民および移民)を優先する。
- 診断: 集団スクリーニングには非侵襲的検査が望ましい——13C尿素呼気試験(13C-UBT)およびモノクローナル便中抗原検査(HPSA)が推奨される検査である。低有病率環境では、局所的に検証された血清学的検査が陽性の場合、非血清学的検査による確認が必要である。
- 治療: 局所的な有効性が証明されている場合、経験的治療は引き続き許容される。ビスマス製剤4剤併用療法(BQT)は、特にクラリスロマイシン耐性率が中~高度の地域において、推奨される経験的治療の第一選択である。P-CAB(ボノプラザンなど)ベースのレジメン(特にボノプラザン-アモキシシリン2剤併用療法)は、代替案として認められる。
- 管理と安全性: 治療後の除菌確認検査を強く推奨する。抗菌薬適正使用支援(スチュワードシップ)の原則に従う。除菌は食道腺がんのリスクを増加させず、一時的なマイクロバイオームの撹乱は通常6~12ヶ月以内に回復する。
- 計画の実施: 可能な限り、ピロリ菌スクリーニングを既存の予防健康プログラムに統合する。品質保証、コミュニティの関与、および追跡調査システムを組織する。
主要なメッセージポイント:
- 高リスク環境にいるピロリ菌陽性の成人に検査と治療を提供する。除菌を客観的に確認する(13C-UBTまたはHPSA)。
- 経験的治療については、マクロライド耐性率が高い環境ではBQTを優先する。適切な場合にはP-CAB-アモキシシリン2剤併用療法を使用する。
- 感受性試験のガイダンスなしに、クラリスロマイシンやレボフロキサシンを再治療に使用しない。
推奨事項の更新と主な変更点(2020年台北コンセンサスおよび他の以前のガイダンスとの比較)
主な更新とその要因:
- 集団スクリーニング計画の承認に対するより強力な運用サポート。 理由:2つの大規模な実臨床/コミュニティ試験(JAMA 2024; Nat Med 2024)が、スクリーニングと治療が胃がんの発生率を減少させることを示す集団レベルのエビデンスを提供した(ただし、効果量は中程度であり、アドヒアランスや試験デザインの影響を受ける)。
- 治療レジメンの階層の更新: マクロライド耐性率が高い地域では、BQTが引き続き経験的治療の第一選択である。最近のRCTおよびメタアナリシスにより、P-CABベースの2剤/3剤併用療法(例:ボノプラザン-アモキシシリン)が高い除菌率と良好な忍容性を示すことが示された(Gut 2024-2025; Gastroenterology 2022)。
- 除菌確認検査の強調: 除菌を確認し、不必要な再治療を制限するために、治療後(4~6週間後にUBTまたはHPSAを使用)の治癒判定検査をルーチンで行うことを強く推奨する。
- 家族志向のアプローチ: 再感染を減らすために、高有病率コミュニティにおける家族または世帯単位でのスクリーニング/除菌をより明確に推奨し、支持する。
- 安全性の考慮: 長期的なマイクロバイオームおよびレジストームへの影響を体系的に評価し、除菌が集団レベルで食道腺がんのリスクを増加させないことを確認した。
概要表(簡易版):
- スクリーニング対象者: 高発生地域に居住または出身の成人、およびその他の高リスクサブグループ(強く推奨)。
- 推奨されるスクリーニング検査: 13C-UBTまたはモノクローナル便中抗原(強く推奨)。
- 血清学的検査: 低有病率環境において、局所的に検証され、非血清学的検査によって陽性が確認された場合に許容される(条件付き推奨)。
- 一次経験的治療: クラリスロマイシン耐性率が中~高度の地域ではBQTを優先。P-CABベースのレジメンは代替案(強く推奨)。
- 除菌の確認: 高リスク患者では必須、一般的に強く推奨される(強く推奨)。
- 内視鏡検査: 警告症状または追加の高リスクマーカーを持つ感染者に適用。高度な前がん病変または胃がんの既往歴がある場合にのみサーベイランス(経過観察)を実施(強く推奨)。
項目別の推奨事項
(各項目には、コンセンサスで示されたエビデンスレベルと推奨の強さが記載されています)
1) 除菌の理由と効果
- 声明: ピロリ菌は胃腺がんの主要な原因である(高レベルのエビデンス;強く推奨)。
- 除菌は胃がんリスクを低減する(高レベルのエビデンス;強く推奨)。複数のメタアナリシス、RCT、大規模コホート研究が相対リスクの低減を示しており、死亡率へのベネフィットも示唆されている。
2) 優先的にスクリーニングする集団
- 主要ターゲット: 胃がん高発生率地域の成人住民およびこれらの地域からの移民(高レベルのエビデンス;強く推奨)。
- 理由: 負担が地理的領域に集中している。費用対効果モデルが高リスク集団を対象とすることを支持している。
- 推奨される実用的アプローチ: 地域の胃がん発生率をマッピングし、高有病率のサブグループ(特定の民族集団、先住民コミュニティなど)を特定し、招待、検査、治療、追跡のパスウェイを含む組織化されたプログラムを試験的に実施する。
3) 最適な年齢とタイミング
- 声明: 最適な年齢は不確実だが、早ければ早いほど良い。早期の除菌(前がん病変が発生する前)が最大の利益をもたらす(中レベルのエビデンス;条件付き推奨)。
- 実務的注記: モデリングと実現可能性の議論に基づき、高リスク地域で提案されるスクリーニング年齢は通常30代半ばから40代半ばである。大腸がんのFITスクリーニング(45歳)との組み合わせは実用的な選択肢となり得る。
4) スクリーニング検査と診断
- 推奨される検査: 13C-UBTおよびモノクローナルHPSA(高レベルのエビデンス;強く推奨)。
- 血清学的検査: 低有病率環境において、検査法が局所的に検証されている場合は許容される。陽性の血清学的検査結果は、治療前に非血清学的検査による確認が必須である(中レベルのエビデンス;条件付き推奨)。
- 検査のタイミング: 偽陰性を避けるため、PPI/P-CABの使用中または使用直後の検査を避ける(PPI/P-CABは2週間、抗生物質/ビスマス製剤は4週間中止してから検査する)。
5) 治療戦略
- 経験的治療: 局所的に有効であれば許容される(中レベルのエビデンス;強く推奨)。
- 一次治療: クラリスロマイシン耐性率が高い地域では、**ビスマス製剤4剤併用療法(BQT:PPI/P-CAB + ビスマス + テトラサイクリン + メトロニダゾール)**を優先する。地域のデータに基づき10~14日間の治療を推奨。P-CABベースのアモキシシリン2剤併用療法(例:ボノプラザン-アモキシシリン)は、RCTによって支持される有効な代替案である(中~高レベルのエビデンス;強く推奨)。
- ペニシリンアレルギー: BQTを優先する。アモキシシリンを含まないP-CABレジメンも許容される(中レベルのエビデンス;強く推奨)。
- 救済/難治性治療: 感受性を確認せずにクラリスロマイシンやレボフロキサシンを繰り返し使用することを避ける。地域の耐性または薬剤感受性試験(AST)に基づいて救済レジメンを選択する(条件付き推奨)。
6) 抗菌薬適正使用支援(スチュワードシップ)
- 核心的原則: ピロリ菌除菌は感染症の治療であり、適正使用支援の原則に従わなければならない(中レベルのエビデンス;強く推奨)。
- 実務的措置: 流行している耐性の影響を最も受けにくいレジメンを選択する。利用可能な場合は、分子生物学的または培養感受性試験を使用し、感受性に基づいた治療を行う。治癒を確認し、地域の除菌結果と耐性傾向を監視し、アドヒアランスのサポートを優先する。
7) 確認検査と内視鏡検査
- 除菌の確認: 治療完了後4~6週間に13C-UBTまたはHPSAによる確認を推奨する(中レベルのエビデンス;強く推奨)。
- 上部消化管内視鏡検査: 警告症状、胃がんの家族歴、異常な血清ペプシノーゲン、またはその他の高リスク特徴を持つ感染者に推奨される(中レベルのエビデンス;強く推奨)。
- サーベイランス(経過観察): 高度の前がん病変(OLGA/OLGIM III-IV、開放型萎縮)または胃がんの既往歴がある患者には、除菌成功後も推奨される(中レベルのエビデンス;強く推奨)。
8) リスクと長期安全性
- 胃食道逆流症(GERD)と食道腺がん: 除菌は長期的な食道腺がんのリスクを増加させない(中レベルのエビデンス;強く推奨)。
- マイクロバイオーム: 除菌は一時的な糞便マイクロバイオームの撹乱を引き起こすが、通常6~12ヶ月以内に回復する。臨床的意義は不明である(中レベルのエビデンス;条件付き推奨)。
- 薬剤耐性: 個々の耐性の増加は通常一時的であり、ベースラインレベルに戻るが、集団および環境への影響については慎重な監視と管理が必要である(低~中レベルのエビデンス;条件付き推奨)。
9) 家族とコミュニティのアプローチ
- 家族志向のスクリーニングと治療は、家族内感染を減少させ、高有病率コミュニティにおける除菌成功率を向上させる可能性がある(中レベルのエビデンス;条件付き推奨)。
- プログラム例: 台湾の馬祖島プログラム、その他の先住民コミュニティでの取り組み、および家族インデックスアプローチが、実現可能性と影響を示している。
専門家のコメントと洞察
コンセンサスグループの見解(意訳):
- 「ピロリ菌除菌は現在、多くの環境において胃がんの一次予防ツールとして検証されている。」(核心的見解)
- 専門家は、利益の大きさはベースラインリスク、アドヒアランス、タイミングによって異なると強調した。計画が高発生地域を優先し、高い参加率と検証された除菌を達成した場合に、最大の集団的利益が得られる。
- 委員会は、普遍的スクリーニングと対象を絞ったスクリーニングについて議論した。コンセンサスは、高リスク地域と集団を優先することを支持し、同時に他の場所でのパイロットプログラムとローカル評価を推奨した。
- 論争が残る点: スクリーニングを開始する最適な年齢。広範な除菌と抗菌薬適正使用支援とのバランス。長期的なマイクロバイオームと集団の耐性への影響。そして、ピロリ菌プログラムを既存のがんスクリーニングサービスと最適に統合する方法。
専門家による主要な実務的メッセージ:
- スクリーニングと治療を、品質指標(招待/登録率、検査受検率、治療完了率、治癒判定検査率、および地域の除菌成功率)を設定した組織的プログラムとして実施する。
- 地域の耐性サーベイランスを用いて経験的選択を導く。耐性検査が利用可能な場合は、分子生物学的ASTを使用して治療を個別化する。
- 強力な患者教育とアドヒアランスサポートを確保する。完了率を高めるために、固定用量配合剤または簡素化されたレジメンを考慮する。
実践的意義:コンセンサスを実践に移す
医療システムレベルでの考慮事項:
- コストを節約し、確立された招待インフラを活用するために、ピロリ菌スクリーニングを既存の予防サービス(例:可能であれば、便中抗原サンプリングと大腸がんFITを組み合わせる)に統合する(JAMA実臨床試験および台湾の国家プラットフォームによって提供されたエビデンスと事例)。
- パイロット実施: 高発生地域または高リスクサブグループから開始し、実現可能性を示し、紹介パスウェイを調整し、局所的に費用対効果を最適化する。
臨床実践ワークフロー(推奨):
- スクリーニング候補者の特定(高発生地域の成人またはその他の高リスク基準)。
- 非侵襲的検査の提供——13C-UBTまたはモノクローナル便中抗原を優先。
- 陽性の場合、利益/リスクについてカウンセリングし、地域の耐性に基づいて選択されたレジメンで除菌治療を提供する。
- 治療後、治療完了から少なくとも4~6週間後、かつPPI/P-CAB中止後に治癒判定検査(13C-UBTまたはHPSA)を行う。
- 持続感染の場合、利用可能な感受性試験に基づいて救済レジメンを選択する。マクロライド/フルオロキノロンの経験的な再使用を避ける。
- 警告症状、異常なペプシノーゲン、または家族歴のある患者は、内視鏡検査とリスク層別化(OLGA/OLGIM)のために紹介する。
患者ケース(例):
ジョン氏、48歳の韓国系アメリカ人男性。警告症状はないが、胃がんの家族歴あり(父親が62歳で診断)。プライマリケアを受診。彼の背景を考慮し、ピロリ菌検査を受け、13C-UBTは陽性。カウンセリングの後、14日間のBQT(地域のクラリスロマイシン耐性率>15%)を受けた。彼は治療を完了し、軽度の悪心のみであった。治療6週間後、13C-UBTは陰性——治療成功と記録された。彼の家族歴を考慮し、OLGA/OLGIMの結果に基づいたリスク層別化とサーベイランス計画のために、上部消化管内視鏡検査とベースラインの胃マッピングが予定された。
将来の研究優先分野(コンセンサスランキング)
ガイドラインは9つの優先研究分野を挙げている。そのうちの主なものは以下の通りである:
- 生涯にわたる利益と費用対効果を最大化するための、スクリーニングの最適年齢の特定。
- 前がん病変を持つ患者のサーベイランス間隔と戦略の定義(OLGA/OLGIMによる層別化)。
- 除菌がマイクロバイオーム、代謝、および免疫に及ぼす集団レベルでの長期的影響に関する研究。
- ピロリ菌ワクチン(予防的および治療的)および非抗生物質療法(ウレアーゼ阻害剤、抗付着剤)の開発と臨床試験。
- 集団のアウトカム、耐性生態学、および大規模な抗生物質使用の環境への影響を評価する、大規模な多国間実施研究。
変わらないこと——永続的な原則
- ピロリ菌は依然としてクラス1の発がん物質であり、胃がん予防のための実行可能なターゲットである。
- 内視鏡検査のキャパシティが存在し、疾患負担が非常に高い場合、除菌と内視鏡スクリーニングを組み合わせることは引き続き合理的な戦略である。
- 治癒判定検査の確認は、除菌を検証し、不必要な再治療を制限するための、良好な臨床実践の礎であり続ける。
最終考察:利益、リスク、実現可能性のバランス
2025年台北グローバルコンセンサスIIは、この分野を概念的な承認から、実用的でエビデンスに基づいた実施の推奨へと移行させた。このガイドラインは、除菌が胃がんリスクを低減し、消化性潰瘍を予防できることを強調するが、集団レベルでの効果はプログラムの設計にかかっている:誰が招待され、どの検査が使用され、どのレジメンが選択され、そして除菌確認検査とサーベイランスのインフラが存在するかどうかである。抗菌薬適正使用支援と耐性の継続的な監視は不可欠であり、全身的な抗生物質への依存を減らすであろう研究への投資——特にワクチン開発と非抗生物質療法——も同様に重要である。
臨床医と公衆衛生のリーダーにとって、メッセージは明確である:胃がんリスクが高い環境において、品質保証、コミュニティの関与、およびスチュワードシップの保護措置を備えた組織的なピロリ菌スクリーニングと治療プログラムを確立することは、今やより強力なエビデンスと実用的な推奨によって支持されている。
参考文献
(本稿で引用された主要な参考文献。完全なコンセンサスには包括的な参考文献リストが含まれています。)
1. Liou JM, Malfertheiner P, Hong TC, et al. Screening and eradication of Helicobacter pylori for gastric cancer prevention: Taipei Global Consensus II. Gut. 2025;74:1767–1791. doi:10.1136/gutjnl-2025-336027 IF: 25.8 Q1 .2. Lee Y-C, Chiang T-H, Chiu H-M, et al. Screening for Helicobacter pylori to Prevent Gastric Cancer: A Pragmatic Randomized Clinical Trial. JAMA. 2024;332:1642–1651.
3. Pan K-F, Li W-Q, Zhang L, et al. Gastric cancer prevention by community eradication of Helicobacter pylori: a cluster-randomized controlled trial. Nat Med. 2024;30:3250–3260.
4. Malfertheiner P, Megraud F, Rokkas T, et al. Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus. Gut. 2022;71:1724–1762.
5. Chey WD, Howden CW, Moss SF, et al. ACG Clinical Guideline: Treatment of Helicobacter pylori Infection. Am J Gastroenterol. 2024;119:1730–1753.
6. Best LM, Takwoingi Y, Siddique S, et al. Non-invasive diagnostic tests for Helicobacter pylori infection. Cochrane Database Syst Rev. 2018;CD012080.
7. Liou JM, Jiang X-T, Chen C-C, et al. Second-line levofloxacin-based quadruple therapy versus bismuth-based quadruple therapy and long-term microbiota/resistome outcomes: Lancet Gastroenterol Hepatol. 2023;8:228–241.
8. Lee Y-C, Chiang T-H, Chou C-K, et al. Association Between Helicobacter pylori Eradication and Gastric Cancer Incidence: A Systematic Review and Meta-analysis. Gastroenterology. 2016;150:1113–1124.
9. Fukase K, Kato M, Kikuchi S, et al. Effect of eradication of Helicobacter pylori on incidence of metachronous gastric carcinoma after endoscopic resection: Lancet 2008;372:392–397.
10. WHO. Antimicrobial stewardship programmes in healthcare facilities (toolkit). Geneva: WHO; 2019.