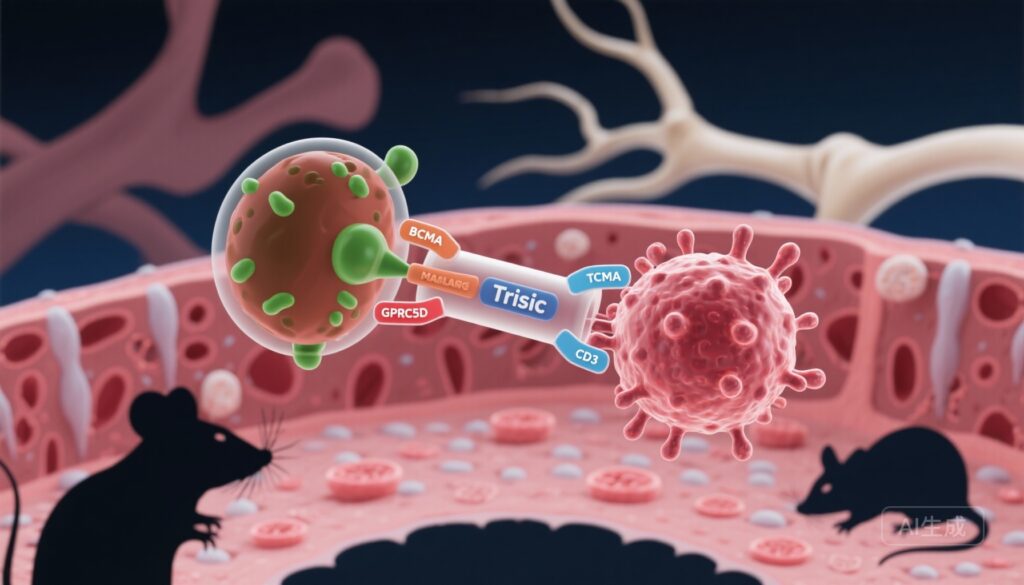
ハイライト
– ラマンタミグ (JNJ-79635322) は、BCMA、GPRC5D、CD3 を標的とする三特異性 T 細胞エンゲージャーで、腫瘍結合親和性を高め、抗原喪失による耐性を克服することを目的としています。
– 前臨床モデルでは、ラマンタミグはサブナノモル濃度で強力な細胞毒性を示し、患者の体外アッセイや全血共培養系で悪性血漿細胞を除去し、マウス移植モデルで腫瘍予防と退縮効果を示しました。
– これらのデータは、臨床への翻訳を支持しており、再発/難治性多発性骨髄腫に対する2つの第1相試験 (NCT05652335, NCT06768489) が進行中です。
背景と未解決の課題
多発性骨髄腫は、骨髄内のクローン性増殖、持続的なゲノム進化、および治療後の頻繁な再発を特徴とする血漿細胞の悪性腫瘍です。自己免疫 T 細胞を動員する抗原指向免疫療法(例えば、双特異性 T 細胞エンゲージャーや CAR T 細胞)は、特に B 細胞成熟抗原 (BCMA) を標的とする患者の予後を改善しています。しかし、腫瘍の異質性、抗原の低下または喪失、そして免疫抑制的な骨髄微小環境のために、持続的な制御は困難です。
二重標的アプローチは、抗原逃避を軽減し、親和性効果を通じて標的結合を増加させることを目指しています。GPRC5D (G タンパク質共役受容体クラス C グループ 5 メンバー D) は、血漿細胞に高表达され、BCMA とは異なるパターンを持つ補完的な骨髄腫抗原として注目されています。これにより、同時標的化の合理性が提供されます。BCMA と GPRC5D の両方を標的とする三特異性構造体は、悪性血漿細胞に対する選択性を高め、細胞毒性の強度を向上させ、単一抗原の喪失によって腫瘍細胞が逃れる機会を減らすように設計されています。
研究デザイン(前臨床概要)
Pillarisettiらの論文では、BCMA と GPRC5D に結合し、T 細胞の CD3 に結合する三特異性抗体であるラマンタミグ (JNJ-79635322) の前臨床特性が説明されています。評価には、エンジニアリングされた細胞株や多発性骨髄腫細胞株に対する体外細胞毒性アッセイ、T 細胞活性化アッセイ、患者由来骨髄サンプルを使用した体外共培養実験、健康ドナーの血液に骨髄腫細胞を添加して使用した全血共培養アッセイ、免疫不全マウス移植モデルでの体内効果試験が含まれています。
主要な実験エンドポイントは、腫瘍細胞殺傷効果 (EC50)、T 細胞活性化マーカーとサイトカイン放出、患者由来サンプルでの悪性血漿細胞の除去、マウスモデルでの腫瘍成長抑制と退縮でした。単一抗原または両方の抗原を発現する細胞株に対する構造体の活性が明確にテストされ、二重標的化の追加価値が探られました。
主要な知見
体外効果と T 細胞活性化
ラマンタミグは、多発性骨髄腫細胞株に対してサブナノモル濃度で強力な濃度依存性の細胞毒性を示し、高い機能的効果が確認されました。三特異性構造体は、腫瘍細胞溶解と並行して T 細胞を活性化(活性化マーカーの上昇と効果サイトカインの産生)しました。重要なことに、ラマンタミグは、BCMA または GPRC5D のいずれかが存在する場合でも細胞毒性を媒介できることが示されました。
患者由来悪性血漿細胞の体外除去
多発性骨髄腫患者の骨髄サンプルを使用した体外 T 細胞共培養アッセイでは、ラマンタミグは悪性血漿細胞の用量依存性の除去を示しました。プライマリ材料でクローン性血漿細胞集団を減少させる能力は、重要な翻訳シグナルであり、自己人間 T 細胞との相互作用と臨床的に関連する疾患細胞への標的化能力を支持しています。
全血共培養—生理性状況
より生理学的な環境を近づけるために、著者らは健康ドナーの新鮮な全血と H929 骨髄腫細胞を共培養しました。これらの条件下で、ラマンタミグは用量依存性の腫瘍細胞除去を引き起こし、他の血液成分の存在下での機能的活性を示し、循環中の標的結合と効果機能の側面を反映している可能性があります。
移植モデルでの体内効果
ラマンタミグは、マウス移植モデルで強力な抗腫瘍効果を示しました。単一標的を発現するクローン細胞を使用した予防モデルでは、ラマンタミグは腫瘍の成立を阻止しました。2つの退縮モデルでは、三特異性剤が腫瘍の縮小を誘導し、予防と治療コンテキストでの体内効果を支持しました。ほとんどの移植研究と同様に、これらのモデルは免疫不全マウスを使用し、ヒト T 細胞の再構成または採用移行によって効果細胞を提供します。それでも、体内抗腫瘍効果の重要な概念実証を提供しています。
抗原カバレッジと耐性の考慮事項
単一抗原または二重抗原を発現する細胞に対する構造体の活性は、重要なメカニズム的観察です。二重標的化は、骨髄内の異質なクローン集団を認識する確率を高め、1つの標的抗原を低下させた細胞を選択する圧力を減らします。これらの特徴は、患者で確認された場合、より深いかつ持続的な寛解につながる可能性があります。
安全性のシグナルと翻訳上の考慮事項
前臨床研究は効果とメカニズムに焦点を当てており、詳細な安全性と毒性評価は臨床データが必要です。ただし、いくつかの重要な翻訳上の考慮事項が生じます:
- オンターゲット、オフターゲット効果:BCMA と GPRC5D は血漿細胞に富んでいますが、正常な血漿細胞の除去は予想されるオンターゲット効果です。GPRC5D の発現は、一部の研究でケラチン化組織(髪の毛や爪)と関連付けられており、GPRC5D 標的化双特異性薬剤の臨床経験では皮膚や爪の異常が報告されており、監視が必要です。
- サイトカイン放出と神経毒性:CD3 標的化療法は一般的にサイトカイン放出症候群 (CRS) を引き起こし、より少ない頻度で免疫効果細胞関連神経毒性症候群 (ICANS) を引き起こします。これらのイベントの規模とタイミングは、投与量、投与経路、構造体固有の特性(親和性と価数)に依存し、早期フェーズ試験で評価する必要があります。
- T 細胞のフィットネスと疲労:持続的な抗腫瘍制御には持続的な T 細胞機能が必要です。反復または長期の T 細胞活性化は疲労を引き起こす可能性があり、組み合わせ戦略や順次療法が必要になるかもしれません。
- 薬物動態と投与量:三特異性分子は、双特異性分子やモノクローナル抗体と比較して異なる薬物動態 (PK) プロファイルを持つ可能性があります。効果を最大化しながら毒性を制限する最適な投与量レジメンは、第1相試験で決定されます。
専門家のコメントと制限事項
ラマンタミグは、骨髄腫における抗原標的化パラダイムの論理的な延長です:2つの非同一の腫瘍関連抗原と T 細胞を動員することで、腫瘍選択性を向上させ、耐性を低減することを目指しています。提示された前臨床データセットは、細胞株のみの研究を越えた重要な翻訳ステップである患者由来材料を含む複数の補完的なアッセイで、多角的に有望な効果を示しています。
ただし、臨床データが得られるまで、重要な制限が存在します。前臨床移植モデルは、ヒト骨髄微小環境、免疫調節信号、または免疫-腫瘍相互作用の長期的なダイナミクスを完全に再現していません。安全性プロファイルは効果研究から推測することはできません。CD3 標的化剤は通常、慎重な用量段階と CRS 対策戦略(ステップアップ投与、副腎皮質ステロイドまたは IL-6 阻害剤の準備)を必要とします。最後に、三特異性分子の製造の複雑さと PK 行動は、スケーラビリティと臨床展開に影響を与える可能性があります。
臨床開発と次なるステップ
前臨床データセットは、再発/難治性多発性骨髄腫に対する第1相臨床試験の開始を支持しています:NCT05652335 と NCT06768489。これらの試験では、最大許容量 (MTD) または第2相推奨量 (RP2D)、安全性(CRS、神経毒性、オフターゲット効果に重点)、薬物動態と薬効学、初期の効果シグナル(奏効率と最小残存病変 [MRD] 評価)が定義されます。
将来の臨床的な問いには、三特異性剤が既存の BCMA 標的化モダリティ(CAR T 細胞、双特異性分子、抗体-薬物複合体)と比較してどのように位置付けられるか、BCMA 標的化療法後に再発した患者を救済できるか、チェックポイント制御、免疫刺激剤、または微小環境標的化剤との合理的な組み合わせが持続性を向上させることができるかが含まれます。
結論
ラマンタミグ (JNJ-79635322) は、BCMA と GPRC5D を標的とする三特異性 T 細胞エンゲージャーで、体外、体外、体内モデルで強力な前臨床抗骨髄腫効果を示しています。単一抗原または二重抗原を発現する細胞を標的化する能力は、腫瘍の異質性と抗原喪失による耐性に対処するためのメカニズム的な利点を提供します。進行中の第1相試験は、再発/難治性多発性骨髄腫患者における安全性、忍容性、および前臨床の利点が持続的な臨床反応に翻訳されるかどうかを決定するために重要です。
資金提供と ClinicalTrials.gov
本研究は、開発組織に所属する研究者によって実施され、ソース原稿に報告されている企業リソースによって支援されました。再発/難治性骨髄腫に対するラマンタミグの臨床試験:NCT05652335 と NCT06768489。
参考文献
Pillarisetti K, Yang D, Luistro L, Yao J, Smith M, Vulfson P, Testa J Jr, Ponticiello R, Brodeur SR, Heidrich B, Packman K, Singh S, Attar RM, Elsayed YA, Philippar U. Ramantamig (JNJ-79635322), a novel T-cell-engaging trispecific antibody targeting BCMA, GPRC5D, and CD3, in multiple myeloma models. Blood. 2025 Oct 16:blood.2025030027. doi: 10.1182/blood.2025030027. Epub ahead of print. PMID: 41100731.