ハイライト
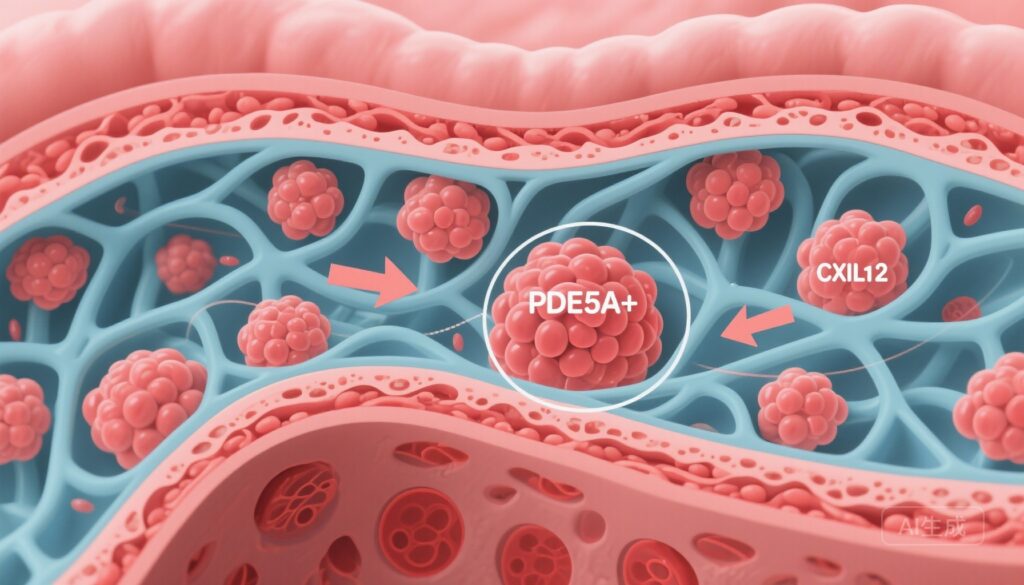
– 胃がんでPDE5A+ CAFサブセットが全体生存期間の短縮と免疫除外型腫瘍微小環境(TME)に関連していることが確認されました。
– PDE5A+ CAFは、細胞外基質(ECM)の再構成や上皮-間葉系転換(EMT)を促進し、PI3K/AKT/mTORシグナルを活性化してCXCL12を分泌し、CXCR4+ LAG3+疲弊したCD8 T細胞を誘引します。
– 前臨床モデルでは、ヴァルデナフィルによるPDE5Aの薬理学的阻害とLAG3ブロックの併用が、抗腫瘍免疫を有意に改善し、腫瘍成長を抑制することから、翻訳研究の評価が支持されています。
背景と臨床的文脈
胃がんは依然として世界中で主要ながん死亡原因です。手術、化学療法、標的療法の進歩にもかかわらず、免疫チェックポイント阻害剤(ICIs)からの持続的な利益は患者の一部に限られています。ICIsに対する反応性の主要な決定要因は、非悪性間質細胞(特にがん関連線維芽細胞(CAFs))が樹立する物理的および生化学的バリアによって細胞性Tリンパ球(CTLs)を排除したり、免疫細胞を機能不全または抑制的な状態に偏らせたりする腫瘍微小環境(TME)です。免疫抑制を媒介するCAFsサブセットを特定することで、胃がんに対する免疫療法の感受性を高める新たな組み合わせ治療戦略が開発できる可能性があります。
研究デザインと方法
Wangらは、24人の胃がん患者の腫瘍サンプルの統合単一細胞RNAシークエンス(scRNA-seq)と、症例群と対照群のホルマリン固定パラフィン包埋(FFPE)組織切片の空間トランスクリプトミクスを実施しました。これらの多様なデータを用いて、細胞構成をマッピングし、CAFsサブポピュレーションを定義し、分子シグネチャーを臨床結果と空間免疫パターンに関連付けることができました。
主な実験アプローチには、遺伝子発現が異なるCAFsクラスタの同定、CAFsシグネチャーの全体生存期間とCD8+ T細胞浸潤との相関、胃がん上皮細胞と基質再構成へのCAFsの影響を評価する体外機能アッセイ、CAFsがケモカインを分泌するメカニズムの研究、PDE5阻害剤(ヴァルデナフィル)とLAG3免疫チェックポイントブロックを組み合わせた治療の効果を検証するマウスモデルの使用が含まれています。
主要な知見
1. PDE5A+ CAFの発見と臨床的関連性
scRNA-seqと空間マッピングを用いて、リン酸ジエステラーゼ5A(PDE5A)の高発現を特徴とする再現可能なCAFsサブポピュレーションが同定されました。PDE5A+ CAFシグネチャーは、胃がん患者の全体生存期間の悪化と、CD8+細胞性Tリンパ球の腫瘍巣への浸潤減少や、間質境界でのT細胞の富集を含む免疫除外型TMEの組織学的特徴との相関を示しました。
2. ECM再構成とEMTの促進
PDE5A+ CAFは、細胞外基質(ECM)の沈着と再構成に関連する遺伝子の上調を示しました。機能的には、コクルチャーと条件培地実験により、これらのCAFsが胃がん細胞の上皮-間葉系転換(EMT)表現型(例えば、ビメントリンの増加、E-カドヘリンの減少)を促進することが示されました。これは、侵襲性を促進し、組織構造や硬さの変化により免疫除外に寄与する可能性があります。
3. PI3K/AKT/mTOR活性化とCXCL12の分泌
メカニズムの探究により、PDE5A+ CAFがPI3K/AKT/mTORシグナルカスケードを活性化し、ケモカインCXCL12の放出を増加させることが明らかになりました。CXCL12は、CXCR4を発現する細胞の強力なケモアトラクタンであり、いくつかの固形腫瘍において効果的T細胞の除外と抑制的または疲弊したリンパ球集団の誘引に関与していることが示唆されています。
4. 疲弊したLAG3+ CD8 T細胞の誘引
空間的および表現型分析により、PDE5A+ CAF領域に疲弊マーカー(LAG3など)を発現するCD8+ T細胞が富集していることが示されました。データは、CAFs由来のCXCL12がCD8+ T細胞上のCXCR4と結合し、間質区画への保持を促進し、LAG3発現を特徴とする疲弊表現型を駆動または維持することで、有効な抗腫瘍反応を鈍化させるモデルを支持しています。
5. 治療的組み合わせ:PDE5阻害とLAG3ブロック
胃がんのマウスモデルでは、ヴァルデナフィルを使用したPDE5Aの薬理学的阻害により、CAFs介在のシグナル出力が減少し、CXCL12レベルも低下しました。単剤療法ではヴァルデナフィルまたはLAG3ブロックは比較的控えめな抗腫瘍効果を示しましたが、その組み合わせは、機能的なCD8+ T細胞の腫瘍内浸潤を相乗的に増加させ、疲弊したT細胞表現型を減少させ、単剤療法よりも腫瘍成長をより効果的に抑制しました。
メカニズムの解釈と生物学的妥当性
提案されたメカニズムは、間質生物学、ケモカイン駆動の白血球の移動、T細胞の機能不全を統合しています。PDE5Aはシクロピリジンモノリン酸(cGMP)リン酸ジエステラーゼであり、CAFsにおいてその上調はPI3K/AKT/mTORシグナル経路の下流活性化と関連しているようです。この経路は、たんぱく質合成、分泌表現型、細胞生存を規制することが知られています。CXCL12の分泌を増加させることで、PDE5A+ CAFはCXCR4+リンパ球を間質に保持し、効果的なCTLと悪性上皮細胞とのエンゲージメントを防ぐケモカイン勾配を生成します。このような抑制的な間質ニッチへの持続的な曝露は、LAG3などの抑制受容体の発現を駆動または維持し、LAG3+疲弊したCD8 T細胞(TEX+表現型)の富集と一致します。CXCL12の生成を抑制するPDE5阻害と、機能的疲弊を介在するチェックポイント(LAG3ブロック)を標的とする両方のアプローチにより、TMEの再構築が合理的に行えると考えられます。
翻訳的および臨床的意義
この研究には、いくつかの魅力的な翻訳的要素があります。まず、ヴァルデナフィルなどのPDE5阻害剤は、既知の薬物動態と安全性プロファイルを持つ、経口投与可能な承認済み薬剤であるため、再利用の取り組みが加速される可能性があります。また、LAG3ブロックは臨床的に実行可能であり、抗LAG3抗体relatlimabは、抗PD-1と組み合わせてメラノーマで規制承認を得ています。したがって、組み合わせ戦略が可能です。
潜在的な臨床戦略には、PDE5A+ CAFシグネチャや免疫除外の空間的証拠を示す腫瘍を持つ患者を対象とした、ヴァルデナフィル(または他のPDE5阻害剤)とLAG3抗体および/またはPD-1軸阻害剤の組み合わせの試験が含まれます。PDE5A発現を検出する空間トランスクリプトミクスや免疫組織化学パネルは、最もうまくいく可能性のある患者を選別するためのコンパニオン診断として使用できます。
制限事項と専門家のコメント
本研究は、多様なモダリティによる説得力のある証拠を提供していますが、いくつかの留意点があります。主なヒューマンディスカバリーコホートは24人の患者から構成されており、探索的なscRNA-seqには適していますが、決定的な臨床相関には限界があります。より大規模な独立コホートでの検証が必要です。前臨床効果はマウスモデルで示されていますが、ヒューマン間質の複雑性、免疫レパートリー、PDE5阻害剤の薬物動態を完全に再現していない可能性があります。全身的なPDE5阻害は、血管トーン、免疫細胞、非CAFs間質成分に対して多面的な影響を及ぼす可能性があり、ヒューマントライアルでの用量選択と毒性モニタリングが重要です。
未解決のメカニズム的な問いがあります。PDE5AのCAFsでの上調を制御する上流レギュレーター、他のCAFsサブタイプ(筋線維芽細胞型vs炎症型CAFs)との潜在的な相互作用、CAFs標的化が他の免疫抑制細胞集団(例えば、制御T細胞、ミエロイド細胞)にどの程度影響を与えるかについてのさらなる研究が必要です。最後に、組み合わせアプローチは、追加毒性と最適なスケジューリング(同時投与vs順次投与)を慎重に評価する必要があります。
次のステップと研究の優先事項
即時の優先事項には、PDE5A+ CAFシグネチャの検証とその予後/予測価値の評価、ICIの結果とリンクされた大規模なGCコホートでの検証、多様な地理的および分子GCサブタイプでの多重免疫蛍光や空間トランスクリプトミクスによるin situ検証、ヴァルデナフィルの用量探索と薬物動態研究、腫瘍を有するホストでの間質変調の定義、およびPDE5阻害剤とLAG3および/またはPD-1ブロックの組み合わせを含む早期フェーズの臨床試験(理想的には生物マーカー選択試験)が含まれます。
結論
Wangらの研究は、これまで認識されていなかったPDE5A+ CAFサブセットが、細胞外基質(ECM)の再構成とPI3K/AKT/mTOR依存性CXCL12分泌を介して胃がんにおける免疫除外型TMEを形成し、疲弊したLAG3+ CD8 T細胞を誘引するメカニズムを特徴づけました。前臨床データでは、ヴァルデナフィルとLAG3ブロックの相乗効果が、間質介在の免疫抑制を逆転する合理的で臨床的に実行可能な戦略を提供することが示されています。大規模なコホートと早期臨床試験で検証されれば、PDE5Aを標的とするアプローチは、生物マーカーを用いた組み合わせ免疫療法の一環として胃がんの治療に組み込まれる可能性があります。
参考文献
1. Wang K, Xie CJ, Ding Z, et al. PDE5A+ cancer-associated fibroblasts enhance immune suppression in gastric cancer. Gut. 2025 Oct 20:gutjnl-2025-335794. doi:10.1136/gutjnl-2025-335794. PMID: 41115748.
2. Kalluri R. The biology and function of fibroblasts in cancer. Nat Rev Cancer. 2016;16(9):582–598.