ハイライト
ST上昇型心筋梗塞(STEMI)後、ガイドライン推奨の低密度リポ蛋白コレステロール(LDL-C)レベルを達成した患者では、新動脈硬化の発生率(7%)が目標値に達成しなかった患者(19%)と比較して有意に低いことが示されました。
多変量解析では、治療中のLDL-Cレベルが25 mg/dL増加するごとに、薬物溶出ステント(DES)植入手術後の3年間で新動脈硬化が発生するリスクが46%上昇することが明らかになりました。
光学干渉断層撮影(OCT)の使用により、全身的な脂質制御がステント留置冠動脈セグメントの微細環境に直接影響を与える高解像度の証拠が提供されました。
これらの知見は、LDL-Cの「低いほど良い」という仮説を補強し、原発動脈のプラーク安定化だけでなく、遅延ステント失敗メカニズムの予防にもその利点が及ぶことを示唆しています。
背景: 遅延ステント失敗の課題
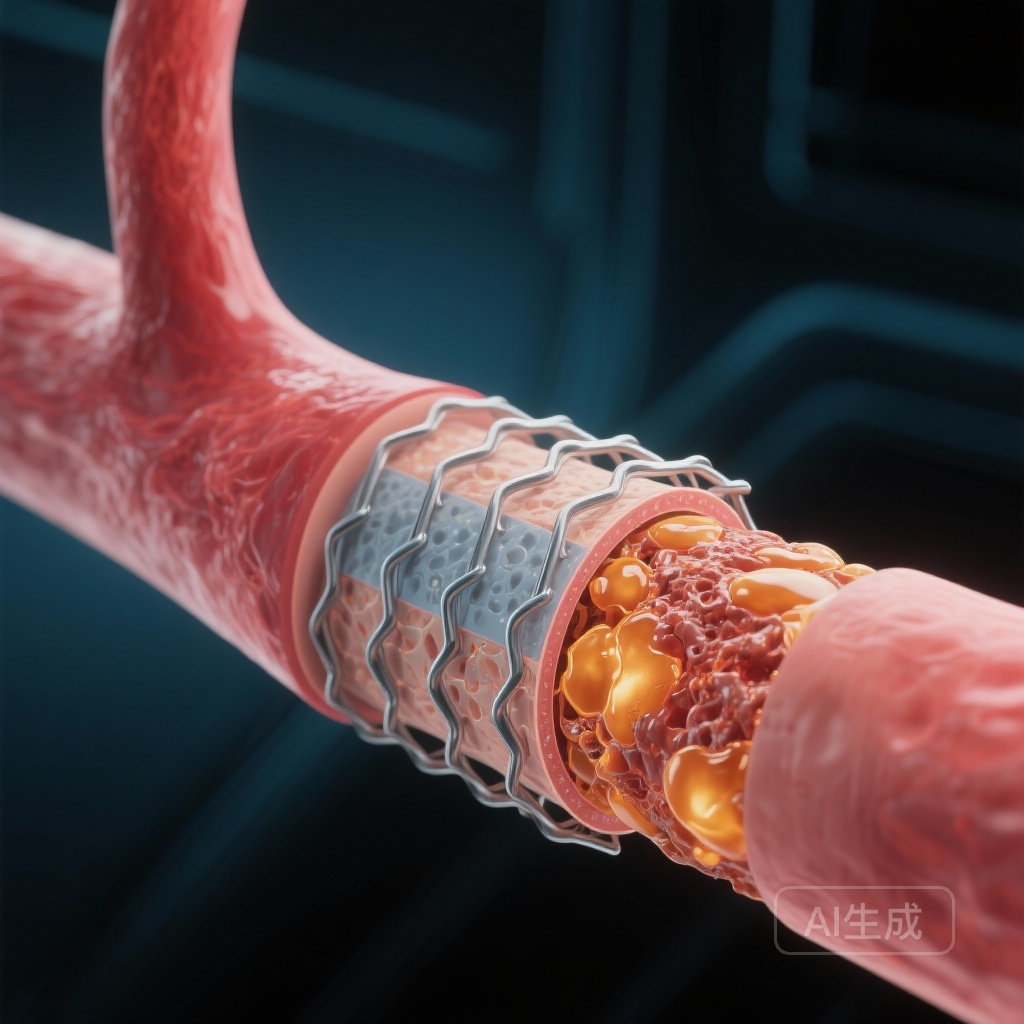
薬物溶出ステント(DES)は早期再狭窄や対象病変再血管化を減少させる革命的な影響を持っていますが、ステント留置セグメントの長期管理は依然として重要な臨床的課題となっています。新動脈硬化——ステント留置セグメントの新生内膜層内で新たな動脈硬化プラークが形成されること——は、遅延および非常に遅延したステント失敗の主要な要因として浮上しています。従来の再狭窄とは異なり、新動脈硬化は平滑筋細胞の増殖ではなく、脂質を含むマクロファージの浸潤、線維動脈瘤の形成、そしてプラーク破裂やステント内血栓症の可能性を伴います。
ST上昇型心筋梗塞(STEMI)の文脈では、炎症環境が高まり、将来の心血管イベントのリスクも上昇しているため、二次予防が不可欠です。低密度リポ蛋白コレステロール(LDL-C)と原発冠動脈疾患の進行との関連はすでに確立されていますが、現代のDESプラットフォーム内の新動脈硬化形成におけるその特定の役割はまだ明確ではありません。この関係を理解することは、PCI後の薬物療法の最適化と長期的な患者アウトカムの改善のために重要です。
研究設計と方法論
本研究は、CONNECT(Biolimus-ElutingとEverolimus-Elutingステント間の新動脈硬化の比較)無作為化臨床試験の事後解析です。スイスと日本の7つの大規模な心臓センターで実施され、2017年から2020年の間に239人のSTEMI患者が、生物分解性ポリマーまたは耐久性ポリマーのeverolimus-溶出ステントを使用した主な経皮的冠動脈介入(PCI)に無作為に割り付けられました。
この二次解析では、3年間生存し、追跡調査の光学干渉断層撮影(OCT)を受けた178人の患者に焦点を当てました。OCTは、近接組織学的な解像度(10-20 μm)を持つため、脂質豊富な新生内膜、マクロファージの蓄積、石灰化などの新動脈硬化特徴を正確に識別できる血管内イメージングの金標準とされています。
患者は、ガイドライン推奨の目標LDL-Cレベル(通常は<55 mg/dLまたは基準値からの50%以上の低下、研究時の地域ガイドラインによる)を達成したか否かに基づいて2つのグループに分類されました。スタチン療法や他の脂質低下剤は標準的なケアに従って処方されました。主要評価項目は、独立コアラボ画像解析によって評価された3年目の新動脈硬化の発生率でした。
主要な知見: 低LDL-Cの保護効果
3年間で評価された178人の患者の平均年齢は63.4歳で、女性は15%でした。コホートは、目標LDL-Cレベルを達成した患者(n = 98, 55%)と達成しなかった患者(n = 80, 45%)に分かれました。脂質制御の差異は明確でした:目標グループの治療中平均LDL-Cレベルは48 mg/dLで、非目標グループは87 mg/dLでした。
新動脈硬化の発生率
結果は驚くべきものでした。目標LDL-Cレベルを達成した患者の7%にのみ新動脈硬化が検出され、目標値を上回った患者の19%に検出されました。これは、脂質制御が不十分な患者の新動脈硬化リスクが3倍に上昇したこと(オッズ比[OR] 3.00; 95% CI 1.19-8.24; P = .02)を意味します。
多変量予測因子分析
潜在的な混雑因子を考慮するために、研究者は多変量ロジスティック回帰分析を行いました。治療中LDL-Cレベルは、新動脈硬化形成の強力かつ独立した決定因子として浮上しました。具体的には、LDL-Cが25 mg/dL増加するごとに、新動脈硬化のリスクが46%上昇しました(OR 1.46; 95% CI 1.09-2.01; P = .01)。他の因子、例えばステントの種類(生物分解性ポリマー vs. 耐久性ポリマー)や基準患者特性は、3年目のこの特定のアウトカムに対する独立した予測因子としては同等の力を示しませんでした。
形態学的特徴
OCT画像は、高LDL群の新動脈硬化病変が不安定なプラークに関連する特性を示す可能性が高いことを明らかにしました。研究は遅延ステント血栓症のような稀な臨床イベントの差を検出するための力を持っていなかったものの、非目標群での脂質豊富な新生内膜の高い頻度は、将来の急性冠症候群の基盤となる可能性が高いことを示唆しています。
専門家のコメント: 機序的洞察と臨床的意義
CONNECT試験解析の知見は、全身的な代謝健康と局所血管治癒の間の重要なリンクを提供しています。新動脈硬化の発生は、薬物-ポリマー被覆が機能的な内皮化を遅らせるために、裸金属ステントと比較してDESで加速すると考えられています。この「漏れ」または機能不全の内皮は、循環中のLDL-Cが新生内膜の下皮空間に容易に移行することを可能にします。
新生内膜内に入ると、LDL-Cは酸化され、マクロファージによって取り込まれ、泡状細胞が形成されます。ステント内の新生内膜は、変化した剪断応力を持つ相対的に隔離された環境であるため、このプロセスは原発動脈硬化よりもはるかに速く進行することがあります——数ヶ月から数年で而不是て数十年です。循環中のLDL-Cを極めて低いレベル(約40-50 mg/dL)に保つことで、医師は脂質が血管壁内に侵入する「圧力」または勾配を実質的に減少させることができます。
臨床的には、この研究は「スタチンプラス」アプローチの必要性を強調しています。試験環境下でも45%の患者が目標値に達成しなかったことから、特に高リスクのSTEMI患者集団では、スタチン以外の療法(ezetimibeやPCSK9阻害薬など)の早期かつ積極的な使用が必要であることが明確です。ステント植入手術は、局所的な問題の「修正」ではなく、より厳格な全身的なリスク因子修正を必要とする触媒であると捉えるべきです。
制限と今後の方向性
データは説得力がありますが、いくつかの制限点に注意する必要があります。事後解析であることから、試験は最初から新動脈硬化のエンドポイントに特化してパワーを設定していませんでした。さらに、3年間の追跡調査は重要ですが、新動脈硬化の全体的な経過、特に5〜10年間での増加を完全に捉えていない可能性があります。また、コホートは主に日本人とスイス人であり、異なる基準の代謝プロファイルを持つ他の民族集団への一般化に制限があるかもしれません。
今後の研究は、超低LDL-Cレベル(例:<30 mg/dL)が新動脈硬化の初期変化を予防するだけでなく、逆転するかどうかに焦点を当てるべきです。さらに、AIを用いたOCT解析の統合は、より自動化され、標準化された大規模な臨床レジストリにおける新動脈硬化の評価を提供する可能性があります。
結論
CONNECT無作為化臨床試験の二次解析は、ST上昇型心筋梗塞(STEMI)後の薬物溶出ステント(DES)植入手術後の新動脈硬化の主要なドライバーが治療中のLDL-Cレベルであるという堅固な証拠を提供しています。ガイドライン推奨の脂質目標を達成することは、ステント内の新しい高リスクプラークの形成を大幅に抑制することと関連しています。これらの結果は、積極的な脂質低下療法が原発疾患の進行を予防するツールであるだけでなく、冠ステントの長期的な構造的および機能的健全性を確保するための基本的な要件であることを示しています。
資金提供と試験情報
CONNECT試験は、さまざまな学術的および臨床的な助成金によって支援されました。ClinicalTrials.gov Identifier: NCT03440801。データ解析は2024年9月から2025年10月にかけて行われました。
参考文献
1. Häner JD, Kakizaki R, Taniwaki M, et al. Low-Density Lipoprotein Cholesterol Levels and Neoatherosclerosis After STEMI: A Secondary Analysis of the CONNECT Randomized Clinical Trial. JAMA Cardiol. 2025; Published online December 17, 2025. doi:10.1001/jamacardio.2025.4723.
2. Otsuka F, et al. Neoatherosclerosis: an overview of the histopathologic findings and implications for stent failure. Eur Heart J. 2015;36(32):2147-2159.
3. Mach F, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020;41(1):111-188.
4. Nakazawa G, et al. The pathology of neoatherosclerosis in human coronary implants bare-metal and drug-eluting stents. J Am Coll Cardiol. 2011;57(11):1314-1322.