ハイライト
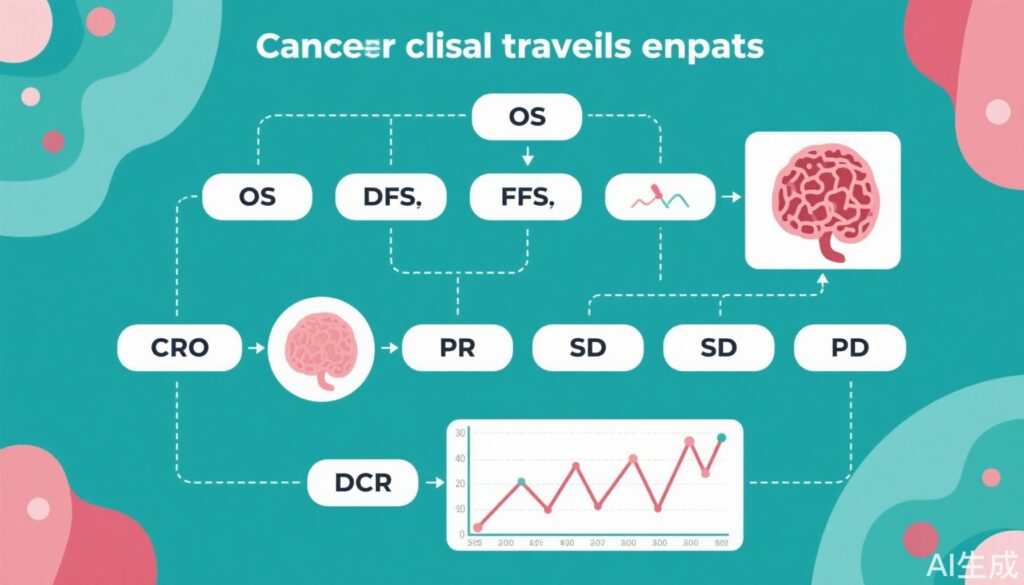
- 主要な腫瘍学試験エンドポイント(OS、DFS、PFS、ORR、CR、PR、SD、PD、およびDCR)の定義と臨床的意義を解説します。
- これらのエンドポイントを臨床実践や研究設定で解釈するための実践的なガイダンスを提供します。
- 各エンドポイントの利点、制限、および異なる試験設計での適切な適用について議論します。
背景と臨床的文脈
腫瘍学の臨床試験は、新しい治療法の有効性を測定するために明確に定義されたエンドポイントに依存しています。がん治療がより多様化し、個別化されるにつれて、これらのエンドポイントを理解することは、医師、研究者、規制当局にとって必要不可欠となっています。全生存期間(Overall Survival, OS)、無病生存期間(Disease-Free Survival, DFS)、無進行生存期間(Progression-Free Survival, PFS)、客観的奏効率(Objective Response Rate, ORR)、完全奏効(Complete Response, CR)、部分奏効(Partial Response, PR)、病勢安定(Stable Disease, SD)、進行(Progressive Disease, PD)、病勢制御率(Disease Control Rate, DCR)などのエンドポイントは、現在、臨床的便益の評価、規制承認、患者へのガイダンスの中心となっています。
世界的ながん負担の増大は、厳密で解釈可能なエンドポイントの必要性を強調しています。GLOBOCAN 2020によると、がんは世界中で死亡原因の一つであり、新薬の有効性を正確に測定することで、意味のある臨床的影響を確保する必要があります [1]。
試験設計の考慮事項: 腫瘍学試験のエンドポイント
腫瘍学試験は、通常、無作為化比較試験(Randomized Controlled Trials, RCTs)または単群試験であり、それぞれ異なるエンドポイント戦略を持っています。エンドポイントの選択は、疾患の段階、予想される結果、患者集団、規制ガイドラインによって異なります。中国の薬剤評価センター(Center for Drug Evaluation, CDE)の「抗腫瘍薬臨床試験の統計設計ガイドライン」は、米国FDAやEMAなどの国際基準を反映しています。
– OS (全生存期間): ランダム化(または単群試験における治療開始)から任意の原因による死亡までの時間。
– DFS (無病生存期間): ランダム化から再発または死亡までの時間。主に補助療法(手術後/放射線治療後)の設定で使用されます。
– PFS (無進行生存期間): ランダム化から腫瘍の進行または死亡までの時間。主に進行性/転移性疾患の設定で使用されます。
– ORR (客観的奏効率): 標準化された基準(例:固形腫瘍のRECIST 1.1)に基づいて、腫瘍縮小(CRまたはPR)を達成した患者の割合。
– CR (完全奏効): 全ての対象病変の消失と腫瘍マーカーの正常化が最低4週間持続すること。
– PR (部分奏効): 対象病変径の合計値が30%以上減少し、少なくとも4週間持続すること。
– SD (病勢安定): PRの基準を満たさないほど縮小せず、PDの基準を満たさないほど増加しないこと。
– PD (進行): 対象病変径の合計値が20%以上増加するか、新たな病変が出現すること。
– DCR (病勢制御率): CR、PR、またはSDが最小期間を超えて持続した患者の割合。
主要な知見と臨床的解釈
1. 全生存期間 (OS): OSは、その客観性と精度により、臨床的便益を評価するための金標準です。測定バイアスに最も影響を受けにくく、普遍的に解釈できます。しかし、OSは長期フォローアップと大規模なサンプルサイズを必要とし、その後の治療ラインやクロスオーバー治療によって有用性が複雑になることがあります。異なる試験間や単群試験間でのOSの比較は、試験間の異質性により信頼性が低いです。
2. 無病生存期間 (DFS) と 無進行生存期間 (PFS): DFSとPFSは、特に長期生存や倫理的制約によりOSが困難な場合の重要な代替エンドポイントとして機能します。DFSは主に補助療法の設定(例:手術後)で使用され、再発または死亡までの時間を示します。PFSは進行性/転移性疾患で一般的に使用され、腫瘍進行のコントロールを反映します。PFSはOSよりも早期に測定できますが、オープンラベル試験や単群試験では評価バイアスに脆弱です。有意義な解釈には対照群が必要であり、画像データは慎重に保管して監査と検証に使用する必要があります。検閲と欠損データへの注意は、統計的妥当性のために重要です [2]。
3. 客観的奏効率 (ORR)、完全奏効 (CR)、部分奏効 (PR): ORRはCRとPRの合計として計算され、腫瘍縮小の直接的な指標であり、早期フェーズや加速承認の設定で広く使用されています。ただし、ORRのみでは反応の持続性や品質を捉えられません。特に再発性や希少のがんにおいて高または前例のないORRを持つ薬剤については、PFSやOSの利益の確認を待つ条件付き承認が規制当局から与えられることがあります。CRとPRはRECISTや類似の基準により明確に定義されており、最小期間(4週間以上)持続する必要があります。
4. 病勢制御率 (DCR)、病勢安定 (SD)、進行 (PD): DCRは、持続的なSDを含むことで反応評価を拡張し、病勢安定自体が臨床的に意味のある便益をもたらすことを認識します。特に細胞成長抑制剤の場合、病勢安定は頻繁に見られませんが、病勢安定が一般的である状況ではDCRが特に重要です。SDはPRまたはPDの基準を満たさない十分な変化がないことを示し、PDは病勢の明確な悪化を示します。DCRの計算式は、DCR = CR + PR + SD(最小期間を満たすもの)、ORR = CR + PRです。
専門家のコメント
エンドポイントの選択と解釈は、疾患の文脈、治療メカニズム、患者のニーズに合わせて調整する必要があります。OSは最も決定的な効果指標ですが、規制当局や臨床実践では、特に未満足なニーズが高い状況や迅速な薬剤開発において、PFSやORRなどの代替エンドポイントの価値をますます認識しています。PFSの評価バイアスへの脆弱性やORRの持続性を反映できないという各エンドポイントの制限は、反応持続期間や反応までの時間などの包括的なエンドポイント報告の重要性を強調しています。
ガイドライン機関(米国FDA、EMA、中国CDEなど)は、試験が画像データと元データを保存し、評価間隔を事前に定義し、進行と反応の基準を明確に記録することを推奨しています。最終的には、特定のがん種や患者集団の文脈に沿って複数のエンドポイントを統合することで、最も堅牢な臨床的便益の評価が得られます。
結論
OS、DFS、PFS、ORR、CR、PR、SD、PD、およびDCRの定義、強み、制限を理解することは、腫瘍学の臨床試験の正確な解釈と情報に基づいた意思決定のための基本です。これらのエンドポイントを適切に選択し解釈することで、医師や研究者は試験結果を現実世界のがん患者の利益に翻訳することができます。
参考文献
[1] Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71(3):209-249.
[2] Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009;45(2):228-247.