ハイライト
– 前向き、多施設単群中心的な重要な試験(ENCIRCLE;Lancet 2025)で、SAPIEN M3を使用した経皮的経隔膜TMVRは、1年間の全原因死亡または心不全再入院の複合レートが25.2%(95% CI 20.6–30.6)となり、事前に設定された性能目標の45%(p<0.0001)を大幅に下回った。
– 手順中には死亡例、手術への転換、左心室流出路(LVOT)閉塞による血行動態障害がなく、1年後のフォローアップ完了率は81%だった。
– この結果は、手術やトランスカテーテルエッジツーエッジ修復(TEER)が不適切な、中等度から重度または重度の大動脈逆流(MR)を有する高リスク患者に対する治療オプションを支持しているが、確認的な無作為化データや長期持続性データが必要である。
背景と未解決の臨床的ニーズ
大動脈逆流は、進行性の症状、心不全、死亡率増加と関連した一般的な弁疾患である。重症MRを有する患者のうち、虚弱、併存疾患、手術リスクの高さにより手術的大動脈弁修復や置換が否定される割合が高い。多くの患者にとって、トランスカテーテルエッジツーエッジ修復(TEER;例:MitraClip)は代替手段となるが、解剖学的制約(大きな接合部ギャップ、弁板病変、石灰化、または輪部拡大)や特定の現象型での不十分な結果により、すべての患者がTEERに適していない。この治療ギャップは、手術やTEERができない患者に対して、経皮的アクセスによる弁置換を提供することを目指すトランスカテーテル大動脈弁置換(TMVR)デバイスの開発を促進してきた。
研究デザイン
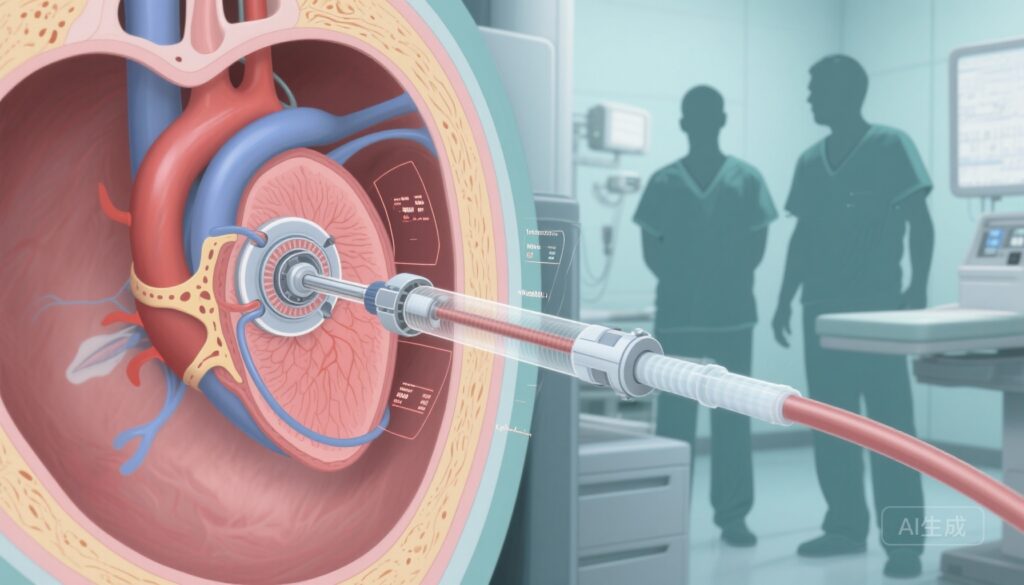
ENCIRCLE試験(NCT04153292)は、手術やTEERが不適切と判断された、18歳以上の有症状の中等度から重度または重度の大動脈逆流を有する成人患者を対象とした前向き、多施設、単群中心的な重要な研究である。6か国(米国、カナダ、英国、オランダ、イスラエル、オーストラリア)の56施設で患者の募集が行われ、登録患者にはEdwards SAPIEN M3 TMVRシステムの経皮的、経隔膜植込が行われた。
主要評価項目は、治療群における1年間の全原因死亡と心不全再入院の複合レートであり、事前に設定された45%の性能目標と比較された。重要な安全性および手順評価項目には、手順中の死亡、LVOT閉塞による血行動態障害、開胸手術への転換が含まれていた。本試験の主催者はEdwards Lifesciencesであり、出版時の報告では試験が進行中であった。
主要な知見
対象群と手順特性
2020年6月9日から2023年10月10日の間に1,171人がスクリーニングされ、299人がSAPIEN M3を使用したTMVRの試みを受けた。中央値年齢は77.0歳(四分位範囲 70.0–82.0)、性別分布はほぼ均等(男性51%、女性49%)だった。大動脈弁置換の30日間死亡率を予測するSociety of Thoracic Surgeons(STS)の平均予測リスクは6.6%で、高リスク集団を示していた。中央値フォローアップ期間は1.4年(四分位範囲 1.0–2.1)で、30日後には283人(95%)、1年後には243人(81%)の臨床フォローアップ情報が得られた。
主要評価項目
治療群の1年間の複合主要評価項目(全原因死亡または心不全再入院)の発生率は25.2%(95% CI 20.6–30.6)で、事前に設定された性能目標の45%(p<0.0001)を大幅に下回った。試験報告書では、この結果が主要な有効性目標を達成したとしている。
周辺手順の安全性と重要な二次観察
注目すべき手順の安全性の知見には、手順中の死亡例、開胸手術への転換、LVOT閉塞による血行動態障害の記録がなかったことが含まれている。論文では、SAPIEN M3を使用したTMVRは、合併症や死亡率が低く、大動脈逆流を効果的に減少させたと述べられているが、残存MRの程度、詳細な死亡と再入院の構成要素、脳卒中、出血、伝導障害、弁血栓、長期抗凝固療法の必要性に関する詳細なデータは、主要論文と補足表に要約されている。
フォローアップの完全性とデータの限界
1年後の臨床フォローアップ情報は、治療群の81%で利用可能だった。多くの単群デバイス研究と同様に、フォローアップの脱落と無作為化比較群の欠如は因果推論を複雑にする。試験では、同時期のコントロール群ではなく、事前に設定された性能目標(45%)を使用した。歴史的コントロールや性能目標はデバイス開発において一般的だが、無作為化比較に比べて固有の限界がある。
解釈と臨床的意義
ENCIRCLE重要な試験は、手術やTEERが伝統的に除外される高リスク集団において、経隔膜TMVRをSAPIEN M3を使用して安全に行うことができ、1年間の死亡と心不全再入院の複合レートが保存的性能基準と比較して臨床的に意味のある減少を示すことを示している。手順中の死亡例、手術への転換、血行動態的に重要なLVOT閉塞がないことは、TMVR技術にとって重要な安全性の指標である。以前のTMVRの経験(特に心尖部アプローチ)は、一部の患者における手順関連の合併症やLVOT閉塞リスクによって制限されていた。
臨床医にとって、本研究は、修復や手術が不適切と判断された重症MRを有する患者に対する追加的な治療経路を示唆している。患者選択は依然として重要であり、デバイス固定のための解剖学的適合性、LVOT形状の評価、輪部寸法、多学科Heart Teamレビューは、登録の主要な構成要素だった。ENCIRCLEで使用された経隔膜アプローチは、胸骨切開や心尖部アクセスを回避し、高齢、虚弱な患者の手順の侵襲性を減らし、回復を改善する可能性がある。
専門家のコメント — 長所、限界、未解決の問題
本研究の長所には、多施設デザイン、新しいデバイスの治療数の大きさ、事前に設定された客観的な評価項目が含まれる。SAPIEN M3の経隔膜設計は、バルーン展開可能なプロテーゼ概念を大動脈位置に適応させた、大動脈解剖学に合わせたトランスカテーテル弁技術の合理的な進化を代表している。
限界については強調する必要がある。最も重要なのは、ENCIRCLEが無作為化比較群のない単群試験である点だ。観察された複合アウトカムは事前に設定された性能目標を大幅に下回ったが、歴史的または性能目標の比較は選択バイアスや患者管理の違いに影響を受けやすい。1年を超えるフォローアップは現在限られており、大動脈位置(高圧、高運動環境への曝露)でのTMVRプロテーゼの耐久性は未解決の問題である。長期観察が必要なデバイス特有の問題には、構造的弁の劣化、血栓形成、弁周囲漏れ、溶血、慢性抗凝固療法の必要性が含まれる。本報告書(ここに提供された要約では)は、脳卒中、血管合併症、伝導障害、生活の質のアウトカムの頻度を詳細に説明しておらず、包括的な評価には不可欠である。
Edwards Lifesciencesによる業界の支援はデバイス開発には適切だが、独立した確認研究とデータ報告の透明性が必要である。今後の研究では、最適な医療療法やTEER(適応可能であれば)との無作為化比較、他のTMVRプラットフォームとの頭対頭比較(解剖学的に適切であれば)、5年以上の長期(>5年)のレジストリやコアラボ評価による結果を追求し、耐久性と遅発性合併症を特徴付けるべきである。
現在の証拠とガイドラインとの整合性
現在の米国と欧州のガイドラインは、手術的修復/置換を優先し、適切な解剖学的条件と手術リスクの高い患者にTEERを推奨している(AHA/ACC 2020;ESC/EACTS 2021/2022)。機能性MRの無作為化TEER研究(COAPTとMITRA-FR)は、患者選択により結果が異なることを示し、慎重に選択された集団ではTEERが心不全入院と死亡率を減少させることを示している。これらの進歩にもかかわらず、持続的なトランスカテーテルや手術の選択肢のない意味のある患者サブセットが存在する。TMVR技術、特に侵襲性の低い経隔膜アクセスは、このギャップを埋めることを目的としており、ENCIRCLEはSAPIEN M3がこの集団での選択肢であることを支持する重要な初期の証拠を提供している。しかし、ガイドラインでのTMVRの採用には、既存の治療法に対する比較有効性と耐久性を定義するための無作為化および長期データが必要である。
臨床医にとっての実践的なまとめ
– 手術が禁忌でTEERが不適切な有症状の重症MRを有する患者において、SAPIEN M3を使用した経隔膜TMVRは、適切に選択された患者において1年間の死亡または心不全再入院を減少させる可能性のある有効な選択肢である。
– 多学科Heart Teamの評価、慎重な手前の画像診断(LVOTリスクや輪部形状のCT評価を含む)、抗凝固療法計画への注意は、結果の最適化とデバイス特有のリスクの軽減に不可欠である。
– 患者との共有意思決定には、TMVRの新規性と進化の性質、長期耐久性の不確実性、パリャティブ医療や利用可能な場合の無作為化比較を含む臨床試験への登録などの代替案の議論が含まれるべきである。
結論
ENCIRCLE重要な試験は、手術やTEERが不適切な、有症状の中等度から重度または重度の大動脈逆流を有する高リスク患者に、SAPIEN M3システムを使用した経皮的経隔膜TMVRを提供することが可能であり、1年間の死亡または心不全再入院の複合レートが事前に設定された性能目標よりも大幅に低いことを示している。これらのデータは、他の選択肢がない患者の治療手段を拡大するものであるが、確認的な無作為化試験、長期フォローアップ、実世界のレジストリ証拠が必要である。
資金提供とClinicalTrials.gov
ENCIRCLEはEdwards Lifesciencesによって資金提供された。ClinicalTrials.gov登録番号:NCT04153292。
参考文献
1. Guerrero ME, Daniels DV, Makkar RR, et al.; ENCIRCLE Trial Executive Committee and Study Investigators. Percutaneous transcatheter valve replacement in individuals with mitral regurgitation unsuitable for surgery or transcatheter edge-to-edge repair: a prospective, multicountry, single-arm trial. Lancet. 2025 Oct 27:S0140-6736(25)02073-2. doi: 10.1016/S0140-6736(25)02073-2. Epub ahead of print.
2. Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease: Executive Summary. Circulation. 2021;143(5):e35–e71. doi:10.1161/CIR.0000000000000923.
3. Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022;43(7):561–632. doi:10.1093/eurheartj/ehab395.
4. Feldman T, Kar S, Rinaldi M, et al. Percutaneous Mitral Repair with the MitraClip System. N Engl J Med. 2011;364(15):1395–1406. doi:10.1056/NEJMoa1008823.
5. Stone GW, Lindenfeld J, Abraham WT, et al. Transcatheter Mitral-Valve Repair in Patients with Heart Failure. N Engl J Med. 2018;379(24):2307–2318. (COAPT trial). doi:10.1056/NEJMoa1806640.
6. Obadia JF, Messika-Zeitoun D, Leurent G, et al. Percutaneous Repair or Medical Treatment for Secondary Mitral Regurgitation. N Engl J Med. 2018;379(24):2297–2306. (MITRA-FR trial). doi:10.1056/NEJMoa1805374.
サムネイル画像の指示
現代のカテーテル室で行われる経隔膜大動脈弁置換術の詳細で現実的な医療イラストレーション:心臓カテーテルの透視画像と食道超音波の重ね合わせで、心房中隔を通過し、人工大動脈弁を展開するカテーテルが描かれています。落ち着いたニュートラルな色調、明確な解剖学的ラベル、手術チームが手術衣を着て背景に描かれ、技術的精度と患者の安全性を表現しています。