ハイライト
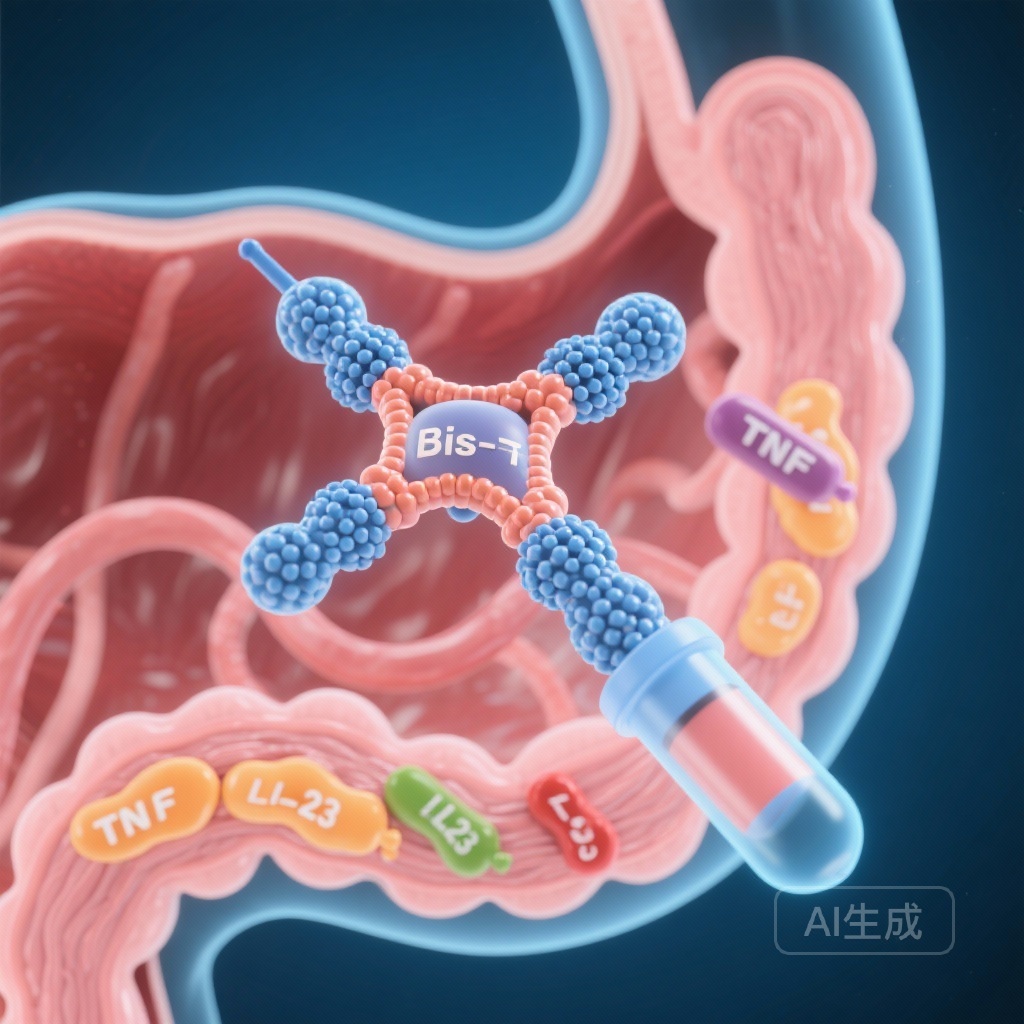
- SOR102は、腫瘍壊死因子(TNF)とインターロイキン-23(IL-23)p19を両方標的とする新しい経口二重特異性抗体です。
- 第1相試験では、健康ボランティアおよび軽度から重度の活動期潰瘍性大腸炎患者において、SOR102が良好に耐容されることを示しました。
- 第3部の初步的な有効性データでは、1日に2回SOR102を投与した群で42日目に56%の臨床反応率が見られ、プラセボ群の17%と比較して有意差がありました。
- SOR102の経口投与により、高濃度の局所腸内濃度と最小限の全身露出が可能となり、注射剤バイオロジックで一般的な全身副作用のリスクが低下する可能性があります。
難治性潰瘍性大腸炎の課題
潰瘍性大腸炎(UC)は、医師にとって依然として重要な治療課題となっています。過去20年間にバイオロジックや小分子薬が増加していますが、多くの患者(しばしば40%から60%と報告される)が現在の標準治療で長期リミッションを達成または維持できない状況が続いています。炎症性腸疾患(IBD)における「治療の上限」は、研究者が二重経路阻害と新たな配達メカニズムの探索を促進させています。従来、抗TNF剤(インフリキシマブなど)と抗IL-23剤(リサンキズマブなど)が主な治療法でしたが、これらの注射剤(静脈内または皮下)は全身副作用や抗薬物抗体の発生に関連しています。
メカニズムの論理:なぜ二重阻害と経口投与なのか?
SOR102はIBD薬理学におけるパラダイムシフトを表しています。単一ドメイン抗体(ナノボディ)から構成された経口二重特異性抗体で、TNFとIL-23のp19サブユニットを同時に標的にします。TNFは急性炎症と粘膜損傷の主要な駆動力であり、IL-23は慢性疾患を維持するTh17メディエート炎症カスケードに重要な役割を果たします。両方の経路を阻害することで、単剤療法の制限を克服する相乗効果を目指しています。
さらに、SOR102の経口製剤は、抗体を直接炎症部位である腸粘膜に届けるように設計されています。このアプローチは、局所的な薬物濃度を最大化し、全身の生物利用度を最小限に抑えることを目指しています。理論的には、全身免疫抑制のリスク(深刻な感染症や悪性腫瘍など)を低減する可能性があります。これは、全身バイオロジックを服用している患者にとって常に懸念される問題です。
試験デザイン:包括的な第1相評価
本試験は、英国、ウクライナ、ジョージアの各センターで行われた初ヒト試験、二重盲検、無作為化、プラセボ対照試験で、3つの異なる部分から構成されていました。主目的は、SOR102の安全性と耐容性を評価することでした。
第1部:単回漸次投与(SAD)
健康ボランティアは(6:2)で単回投与のSOR102(135 mgから3645 mg)またはプラセボを受けました。この段階では、初期の安全性と急性薬物動態に焦点を当てました。
第2部:多回漸次投与(MAD)
健康ボランティアは(8:2)で1日に2回、7日間1215 mgのSOR102またはプラセボを投与されました。この段階では、繰り返し投与の累積安全性を評価しました。
第3部:患者コホート
軽度から重度の活動期UC患者は(1:1:1)で、1日に1回810 mg、1日に2回810 mgのSOR102、または42日の期間でプラセボを投与されました。この部分の試験は、炎症性腸環境での薬物の生物学的活性を観察するために重要でした。
主要な結果:安全性と耐容性
試験には合計64人の参加者が登録されました。試験の全段階において、SOR102は良好な安全性プロファイルを示しました。第1部では、SOR102群の13%とプラセボ群の25%に治療関連有害事象(TEAEs)が見られました。ほとんどの事象は軽度で、ガスや頭痛などの症状が主でした。特に、治療に関連すると判断された軽度の下痢の症例が1件ありました。
患者コホート(第3部)では、SOR102を投与された患者の44%とプラセボを投与された患者の50%にTEAEsが報告されました。1日に2回SOR102を投与された群の2人が潰瘍性大腸炎の悪化を経験しました(そのうち1人は重大なTEAEとして分類されました)。しかし、これらは薬物自体ではなく基礎疾患の進行に関連すると判断されました。重要なことに、生命徴候、検査値、心電図に臨床上有意な変化はなく、死亡例もありませんでした。
初步的な臨床効果:有効性の兆し
第1相試験は主に安全性を評価するために設計されていますが、第3部の結果は早期の臨床利益の強力な証拠を提供しました。42日目までに以下のアウトカムが観察されました:
- Mayoスコア臨床反応:1日に2回SOR102を投与された群の56%が反応を示し、1日に1回投与された群の43%とプラセボ群の17%と比較して有意差がありました。
- 修正Mayoスコア臨床反応:1日に2回投与された群の67%とプラセボ群の33%。
- 症状の寛解:驚くべきことに、1日に2回投与された群の56%と1日に1回投与された群の43%が症状の寛解を達成しましたが、プラセボ群では0%がこのエンドポイントに達しました。
これらのデータは、経口投与されたSOR102が腸の炎症環境を効果的に調節できる量依存性の関係を示唆しています。
専門家のコメント:IBDバイオロジックの新時代?
本試験の結果は、IBDコミュニティにとって非常に有望です。経口二重特異性抗体を投与することで、いくつかの未満足な需要に対応できます。まず、自己注射やクリニックでの点滴よりも患者の服薬遵守率を大幅に向上させる便利さが提供されます。また、局所的な配達メカニズムは、強力な二重阻害を実現しつつ、全身の安全性上の負担を軽減する可能性があります。
ただし、いくつかの質問が残っています。第1相試験では、患者コホートのサンプルサイズが小さかったため、有効性のシグナルを確認するためには第2相と第3相の試験が必要です。さらに、42日を超えた反応の持続性と粘膜治癒の長期的影響を確立する必要があります。医師は、すでに1つ以上の全身バイオロジックに失敗した「バイオ露光」患者でのSOR102のパフォーマンスにも興味を持つでしょう。
結論
SOR102の第1相試験は、主な安全性の目標を達成し、潰瘍性大腸炎における早期の臨床効果の説得力のある証拠を提供しました。TNFとIL-23の二重経路阻害と局所的な経口配達システムを成功裏に組み合わせることで、SOR102はIBD治療の洗練された次世代アプローチを代表しています。これらの結果がより大きなコホートで再現されれば、SOR102は、より便利で、標的が明確で、安全な生物学的治療への移行の基盤となる可能性があります。
資金提供と登録
本試験は、Sorriso Pharmaceuticalsによって資金提供されました。試験はClinicalTrials.govに登録されており、登録番号はNCT06080048です。
参考文献
Jairath V, Danese S, D’Haens GR, Feagan BG, Peyrin-Biroulet L, Sands BE, et al. 安全性と薬物動態:健康参加者および潰瘍性大腸炎患者に対するTNFとインターロイキン-23の経口二重阻害剤SOR102. Lancet Gastroenterol Hepatol. 2026 Jan;11(1):34-45. doi: 10.1016/S2468-1253(25)00296-1.