ハイライト
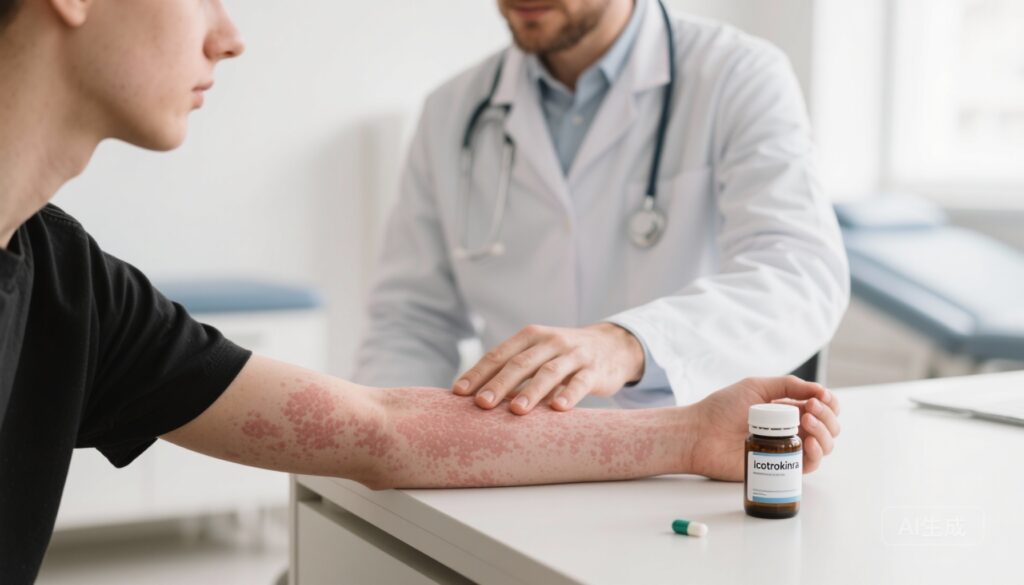
イコトロキンラは、IL-23受容体(IL-23R)を選択的に拮抗する1日に1回投与の経口ペプチドであり、中等度から重度の尋常性乾癬を持つ成人および思春期患者で急速かつ臨床的に意味のある皮膚改善を達成しました。複数の第3相試験(ICONICおよびICONIC-ADVANCE)で主要評価項目が達成され、16週目でのIGA 0/1の割合は約65〜70%、PASI 90の割合は50〜57%でした。16〜24週間の短期安全性はプラセボと概ね同等で、プール解析では経口TYK2阻害薬と比較して有利でしたが、長期追跡が必要です。
背景と未解決の需要
尋常性乾癬は、生活の質を大幅に低下させ、乾癬性関節炎、代謝疾患、精神的負担などの全身性併存症を伴う慢性の免疫介在性炎症性皮膚疾患です。過去10年間で、IL-23(p19)、IL-17、TNFを標的とする生物学製剤が結果を変革し、高い皮膚改善率を可能にしました。しかし、最も効果的な治療法は注射剤が主流であり、効果的で安全性が高く、患者にとって便利な経口投与製剤に対する需要が続いています。イコトロキンラは、IL-23受容体に選択的に結合し、IL-23シグナル伝達をTh17効果細胞の上流で遮断することを目的とした新しいアプローチです。
試験デザインと対象者
ICONIC-LEAD(NEJM報告)
中心的な無作為化二重盲検プラセボ対照第3相試験は、体表面積10%以上、基線PASI 12以上、IGA 3以上の中等度から重度の尋常性乾癬を持つ成人および思春期患者(12歳以上)を対象としました。参加者は、200 mgの経口イコトロキンラを1日に1回24週間投与または16週間のプラセボ投与後にイコトロキンラに切り替えられるように1:2の比率で無作為化されました。主要評価項目は、16週目でのIGA 0/1(クリアまたはほぼクリア、2ポイント以上の改善)とPASI 90(90%以上の改善)の割合でした。
ICONIC-ADVANCE 1と2(Lancet報告)
2つの世界的な第3相試験(ADVANCE 1と2)は、26週間以上の乾癬歴を持つ成人を対象とし、200 mgの経口イコトロキンラ1日に1回、プラセボ、または6 mgの経口デウクラバシチニブ1日に1回に無作為化されました。無作為化スケームは、ADVANCE 1で2:1:2、ADVANCE 2で4:1:4でした。プラセボおよびデウクラバシチニブ群は、予定された週(16週または24週)でイコトロキンラに切り替えられました。主要評価項目はICONIC-LEADと同じで、16週目でのIGA 0/1(2グレード以上の改善)とPASI 90でした。試験は多くのサイトで広範な国際的な対象者を対象とし、二重盲検、活性比較薬制御が行われました。
主要な有効性の知見
ICONIC-LEAD(NEJM)
684人の無作為化参加者(456人イコトロキンラ、228人プラセボ)のうち、イコトロキンラは16週目で有意に高い皮膚改善率を示しました:
– IGA 0/1: イコトロキンラ群65%、プラセボ群8%(P<0.001)。
– PASI 90: イコトロキンラ群50%、プラセボ群4%(P<0.001)。
– 完全クリア(IGA 0): イコトロキンラ群33%、プラセボ群1%。
– PASI 100(完全クリア): イコトロキンラ群27%、プラセボ群<1%。
これらの効果サイズは、成人と思春期の混合集団で16週間以内に有意な臨床効果を示しています。
ICONIC-ADVANCE 1と2(Lancet)
両方のADVANCE試験は16週目で主要評価項目を達成しました。代表的な結果は以下の通りです:
– ADVANCE 1: IGA 0/1の割合は、イコトロキンラ群68%(311人)対プラセボ群11%(156人)、PASI 90の割合は55%対4%(ともにP<0.0001)。
– ADVANCE 2: IGA 0/1の割合は、イコトロキンラ群70%(322人)対プラセボ群9%(82人)、PASI 90の割合は57%対1%(ともにP<0.0001)。
両方のADVANCE試験で、イコトロキンラは約2/3の治療患者で一貫した再現性のある効果を示し、16週目までにIGA 0/1の割合が約2/3、PASI 90の割合が55〜57%に近づきました。
比較的文脈
既存の注射用抗IL-23 p19モノクローナル抗体との直接的な有効性比較はこれらの論文には報告されていませんが、イコトロキンラの反応の大きさは、現代の生物学製剤で同様の時間点で一般的に見られるレベルに近いです。ICONIC-ADVANCEプログラムでは、デウクラバシチニブも活性経口比較薬として含まれており、24週間までの安全性データでは、デウクラバシチニブ群(65%)よりもイコトロキンラ群(57%)での副作用の頻度がやや低かったことが示されました。ただし、デウクラバシチニブとの有効性比較は提供された要約では詳細に記載されておらず、完全な比較解析が利用可能になったときに解釈する必要があります。
安全性と忍容性
試験全体で、16週間までの副作用の全体的な発生率はイコトロキンラとプラセボで概ね同等でした。ICONIC-LEADでは、各グループの49%の参加者が16週間までに少なくとも1つの副作用を報告しました。最も多い報告された副作用は鼻咽頭炎と上気道感染症でした。24週間までの曝露調整発生率は一貫していました。
プールされたADVANCE解析では、16週間までの副作用はイコトロキンラ群の48%とプラセボ群の57%に見られました。最も多い副作用は鼻咽頭炎と上気道感染症でした。24週間時点で、イコトロキンラ群(57%)よりもデウクラバシチニブ群(65%)での副作用の報告が少なかったことがプールデータセットで示されました。
これらの短期解析では予想外の安全性信号は報告されていませんが、IL-23シグナル伝達を調節する治療法の重要な安全性の考慮事項には、感染リスク(特に機会感染)、腫瘍監視への潜在的影響、免疫原性が含まれます。長期データ(数か月から数年)と市販後のモニタリングが必要です。
専門家のコメントと解釈
ICONICプログラムは、IL-23の経口受容体標的拮抗が、多様な乾癬患者群(思春期を含む)で臨床的に意味のある急速な皮膚改善を達成できることを示しています。これらのプログラムの強みには、無作為化二重盲検設計、大規模なサンプルサイズ、試験間で一貫した主要評価項目、ADVANCE試験での活性経口比較薬の包含が含まれます。
メカニズム的には、IL-23はTh17経路の中心的なサイトカインであり、乾癬の検証済みの治療標的です。IL-23 p19サブユニットに対するモノクローナル抗体とは異なり、イコトロキンラは同じ経路の異なるノードであるIL-23受容体に結合します。経口ペプチドフォーマットは、注射を嫌う個人にとって患者の利便性と採用を向上させる可能性があります。
主要な解釈上の注意点には、長期的な慢性疾患管理のための比較的短い主要エンドポイント(16週間)、長期プラセボ比較を制限するプラセボクロスオーバー設計、要約で詳細に開示されていない活性比較薬デウクラバシチニブとの有効性比較の限定的な情報が含まれます。さらに、24週間を超える安全性の評価が必要です。
臨床的および研究的意義
医療従事者にとっては、イコトロキンラは、中等度から重度の尋常性乾癬を持つ多くの患者に対して、現代の生物学製剤に匹敵する有効性を持つ経口オプションとなる可能性があります。その役割は、長期的な有効性の持続性、安全性、患者の好み、コストとアクセス、比較有効性試験によって決まります。重要な未解決の問題には以下が含まれます:
– 6〜12か月を超えるPASI 90/PASI 100の持続性。
– 重大な感染症、悪性腫瘍、心血管イベントなどの長期的安全性。
– 乾癬性関節炎、肥満、生物学製剤の過去の失敗、潜伏性結核など特定のサブ集団でのパフォーマンス。
– 注射用IL-23 p19阻害薬と経口TYK2阻害薬との比較有効性と費用対効果。
さらなる第3相延長データと実世界の証拠が、これらの質問に答える上で重要です。
現在のエビデンスの制限
報告されたデータは16週間の主要エンドポイントに関して堅牢ですが、慢性疾患のアウトカムの短期追跡と、特定のサブグループ解析や活性経口療法との比較に関する比較的限定的な公開詳細が主要な制限です。試験対象者は、重要な併存症や最近の重大な感染症を持つ患者がしばしば除外されるため、一般化が制限されることがあります。最後に、24週間までのプールされた安全性比較は安心材料ですが、希少な有害事象の評価には長期モニタリングが不可欠です。
結論
イコトロキンラは、中等度から重度の尋常性乾癬を持つ成人および思春期患者を対象とした第3相試験で急速かつ有意な皮膚改善を達成した革新的な経口IL-23受容体拮抗薬です。大規模な国際試験で一貫して主要評価項目が達成され、短期安全性はプラセボと概ね同等で、プール比較では経口TYK2阻害薬と比較して有利でした。これらのデータは、イコトロキンラを有望な経口治療オプションとして支持しますが、医療従事者は長期的な有効性と安全性データ、頭対頭の比較解析、実世界の経験を待つ必要があります。
資金提供とClinicalTrials.gov
ICONICおよびICONIC-ADVANCEプログラムは、Johnson & Johnsonによって資金提供されました。臨床試験の登録番号にはNCT06095115(ICONIC-LEAD)、NCT06143878(ICONIC-ADVANCE 1)、NCT06220604(ICONIC-ADVANCE 2)が含まれます。
参考文献
Bissonnette R, Soung J, Hebert AA, et al. Oral Icotrokinra for Plaque Psoriasis in Adults and Adolescents. N Engl J Med. 2025 Nov 6;393(18):1784-1795. doi: 10.1056/NEJMoa2504187. PMID: 41191940.
Gold LS, Armstrong AW, Bissonnette R, et al. Once-daily oral icotrokinra versus placebo and once-daily oral deucravacitinib in participants with moderate-to-severe plaque psoriasis (ICONIC-ADVANCE 1 & 2): two phase 3, randomised, placebo-controlled and active-comparator-controlled trials. Lancet. 2025 Sep 27;406(10510):1363-1374. doi: 10.1016/S0140-6736(25)01576-4. PMID: 40976249.