亮点
- 与富含单不饱和脂肪酸(MUFA)的饮食相比,多因子饮食显著降低了2型糖尿病患者血浆载脂蛋白C-III(ApoC-III)水平。
- ApoC-III水平下降与肝脏和胰腺异位脂肪积累减少相关,这些部位在糖尿病病理生理学中起关键作用。
- ApoC-III水平降低与β细胞功能改善有关,表明内源性胰岛素分泌和血糖调节能力增强。
研究背景及疾病负担
2型糖尿病(T2D)是一种主要的代谢障碍,特征为胰岛素抵抗和β细胞功能障碍,常伴有肝脏和胰腺等器官的异位脂肪积累。这种异位脂肪与胰岛素分泌受损和血糖控制恶化有关。载脂蛋白C-III(ApoC-III)是甘油三酯代谢的关键调节因子,近年来被认为是T2D脂质异常和代谢紊乱的致病因素。ApoC-III水平升高会损害甘油三酯清除,并与心血管疾病风险增加和胰岛素抵抗有关。
针对异位脂肪及相关代谢途径的营养策略已成为改善血糖结局和减少并发症的有前景的方法。先前的研究表明,富含单不饱和脂肪酸(MUFA)的饮食可以积极影响脂质代谢。然而,包含多不饱和脂肪、膳食纤维、多酚和维生素的多因子饮食可能对代谢健康有更优的效果,包括减少异位脂肪。
MEDEA随机对照试验旨在探讨此类饮食对血浆ApoC-III水平及其与异位脂肪积累和β细胞功能关系的影响,以解决通过饮食调节能明确ApoC-III及其相关代谢结果的需求。
研究设计
MEDEA研究是一项随机、对照、平行组临床试验,招募了36名临床诊断为2型糖尿病的成年人,年龄在35至75岁之间(20名男性,16名女性)。参与者被随机分配接受两种等热量饮食干预之一,持续8周:
– 富含单不饱和脂肪酸的饮食(n=16):主要含有单不饱和脂肪。
– 多因子饮食(n=20):富含单不饱和脂肪酸,外加多不饱和脂肪、纤维、多酚和维生素。
评估项目包括基线和8周后的空腹和餐后(3小时测试餐,反映指定饮食)血浆葡萄糖、胰岛素和ApoC-III浓度测量。通过计算餐后测试中的胰岛素与葡萄糖总曲线下面积(AUC)比值来评估β细胞功能。
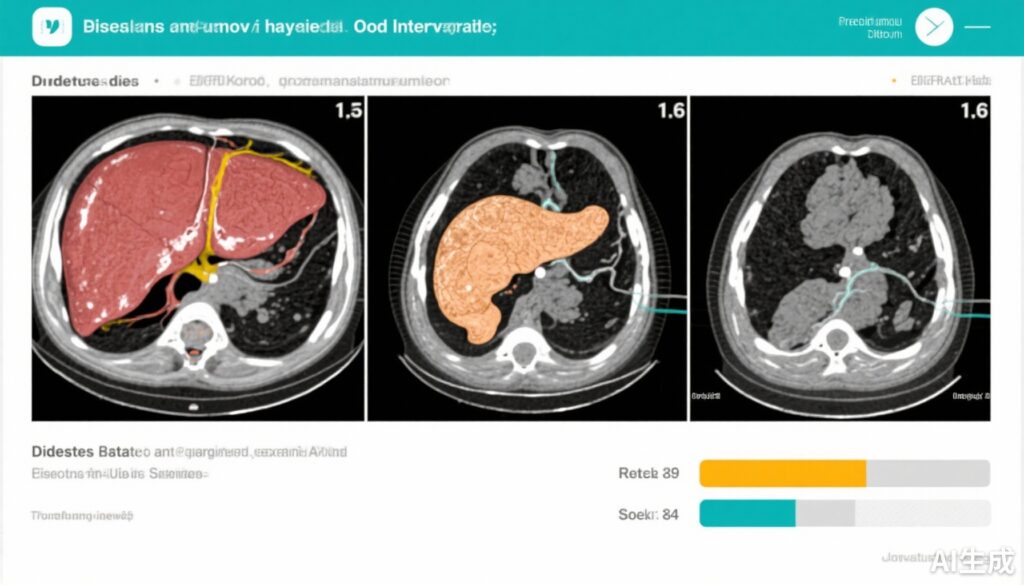
使用先进的磁共振成像(MRI)技术对肝脏和胰腺异位脂肪进行量化,能够精确测量随时间的变化。
主要发现
比较分析显示,与富含单不饱和脂肪酸的饮食相比,多因子饮食显著降低了餐后ApoC-III水平(ApoC-III AUC变化差异:-1.34 ± 6.01 vs +1.60 ± 5.56 g/l × 180分钟;p=0.043)。虽然多因子饮食在空腹状态下的ApoC-III水平下降趋势接近显著(-0.006 ± 0.040 vs +0.007 ± 0.048 g/l;p=0.070),但其效果在餐后状态下更为明显,突显了饮食对餐后代谢反应的影响。
无论饮食分配如何,空腹ApoC-III水平下降与肝脏脂肪减少(r=0.357,p=0.032)和胰腺脂肪减少(r=0.385,p=0.020)呈正相关。这些发现强调了ApoC-III水平与异位脂肪储存之间的密切关联。
此外,无论是空腹还是餐后ApoC-III水平下降均与β细胞功能改善呈负相关(r=-0.384,p=0.026 和 r=-0.402,p=0.018)。这表明较低的ApoC-III水平可能支持增强内源性胰岛素分泌能力,可能是通过减轻胰岛的脂毒性压力介导的。
专家评论
MEDEA研究的共同研究者Alessandra Annuzzi博士指出,“我们的研究结果支持多因子饮食方法作为ApoC-III的有效调节器——ApoC-III在糖尿病进展中越来越受到关注的脂质调节因子。异位脂肪的同时减少和β细胞功能的改善提供了令人鼓舞的机制见解,将饮食、脂质代谢和血糖控制联系起来。”
尽管该研究提供了开创性的见解,但由于其探索性质和相对较小的样本量,存在局限性。需要长期研究和更大规模的队列来验证这些关系并阐明因果关系。此外,多因子饮食的复杂性使得单独确定个别营养成分的贡献具有挑战性,需要进一步的机制评估。
在现有文献的背景下,这些发现与越来越多的证据一致,强调减少肝脏和胰腺脂肪作为T2D的治疗目标,并通过确定ApoC-III调节作为可能的中介生物标志物和治疗目标,扩展了理解。
结论
MEDEA随机对照研究揭示了等热量多因子饮食在2型糖尿病患者中降低血浆ApoC-III水平的作用,这些降低与肝脏和胰腺异位脂肪积累减少以及β细胞功能改善密切相关。
这些结果突显了多因子饮食作为改善T2D患者脂质相关代谢紊乱的饮食干预措施的潜力,并强调了通过靶向ApoC-III介导的途径改善β细胞健康和代谢结果的临床意义。
未来临床实践中可能会将ApoC-III水平测量作为代谢标志物,用于定制饮食疗法和监测异位脂肪变化。需要进一步研究来确认这些益处并探索其机制基础。
参考文献
1. Costabile G, Salamone D, Della Pepa G, et al. ApoC-III and ectopic fat accumulation in individuals with type 2 diabetes: an exploratory analysis from the MEDEA randomised controlled study. Diabetologia. 2025 Sep;68(9):2036-2041. doi:10.1007/s00125-025-06464-w. Epub 2025 Jun 5. PMID: 40471240.
2. Goldberg IJ. Apolipoprotein C-III: Bridging hypertriglyceridemia and insulin resistance in diabetes. Curr Diab Rep. 2019;19(7):35.
3. Lim EL, et al. Reversal of type 2 diabetes: normalization of beta cell function in association with decreased pancreas and liver triacylglycerol. Diabetologia. 2011;54(10):2506-2514.
4. Petersen KF, Shulman GI. Mechanisms of insulin action and insulin resistance. Physiol Rev. 2018;98(4):2133-2223.