ハイライト
– 経口KRAS G12D選択的阻害剤GFH375は、ESMO 2025で発表された多施設フェーズI/II試験において、既治療のKRAS G12D変異膵管腺癌(PDAC)で研究者評価による奏効率(ORR)40.7%、疾患制御率(DCR)96.7%を示しました。
– 中央値無増悪生存期間(PFS)は5.52ヶ月(90%信頼区間 4.27–7.20)、中央値追跡期間5.65ヶ月での中央値全生存期間(OS)は未達、安全性プロファイルは管理可能で、グレード≧3の治療関連有害事象(TEAEs)は31.8%、治療関連死亡例は報告されていません。
背景と未満足なニーズ
膵管腺癌(PDAC)は最も致死的な悪性腫瘍の一つであり、数十年間にわたる微小な改善にもかかわらず、集団レベルでの5年生存率は依然として低くなっています。患者の大多数は切除不能または転移性疾患で発症し、全身療法に依存しており、臨床効果は限定的で、抵抗性が急速に現れます。
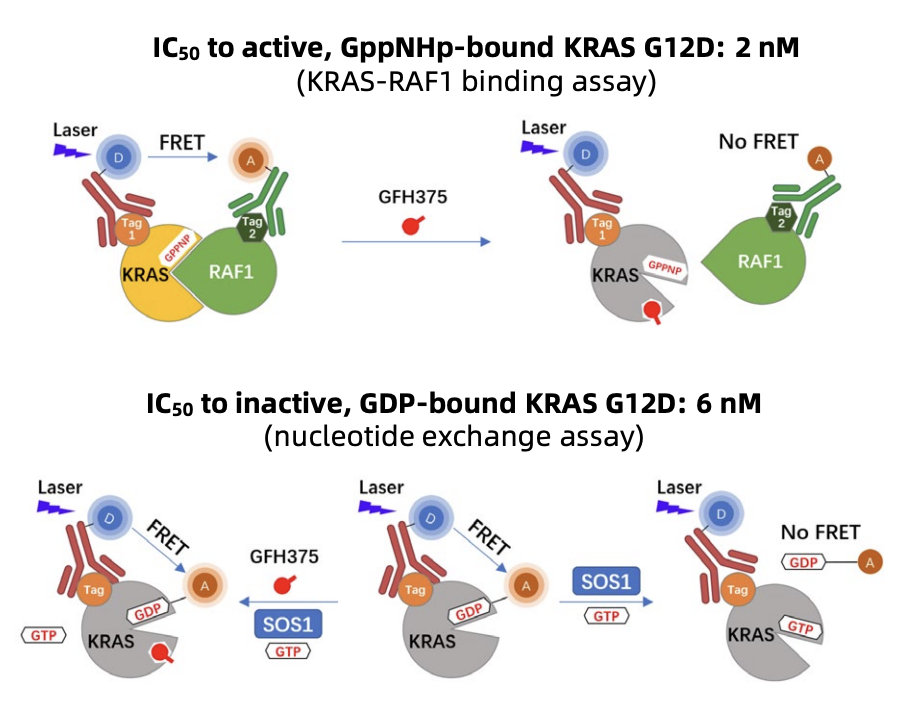
KRASオニコジェンの突然変異はPDACの主要な分子ドライバーであり、90%以上の腫瘍にKRAS変異が存在し、KRAS G12Dは一般的なサブタイプです。歴史的には、KRASは生化学的特性や結合部位の欠如により難治的な標的とされてきました。最近の薬剤設計や構造誘導アプローチの進歩により、G12C向けの選択的KRAS阻害剤が開発され、現在は他のホットスポット突然変異(G12Dなど)を標的とする薬剤も開発されています。KRAS G12D変異PDACで有意な臨床効果を示すことは、この高需要集団にとって大きな治療進展を意味します。
試験デザインと方法
ESMO 2025で発表されたデータは、経口選択的KRAS G12D阻害剤GFH375のグローバル多施設フェーズI/II試験(NCT06500676)から得られています。フェーズI部分には用量上昇(100 mg QDから900 mg QDおよび300 mg BID)と拡大が含まれ、フェーズIIではPDAC、非小細胞肺がん、大腸がんなどの腫瘍特異的コホートが登録されました。ESMOで報告されたデータセットは、推奨用量(RP2D)600 mg 1日1回(QD)で治療されたPDAC患者に焦点を当てています。
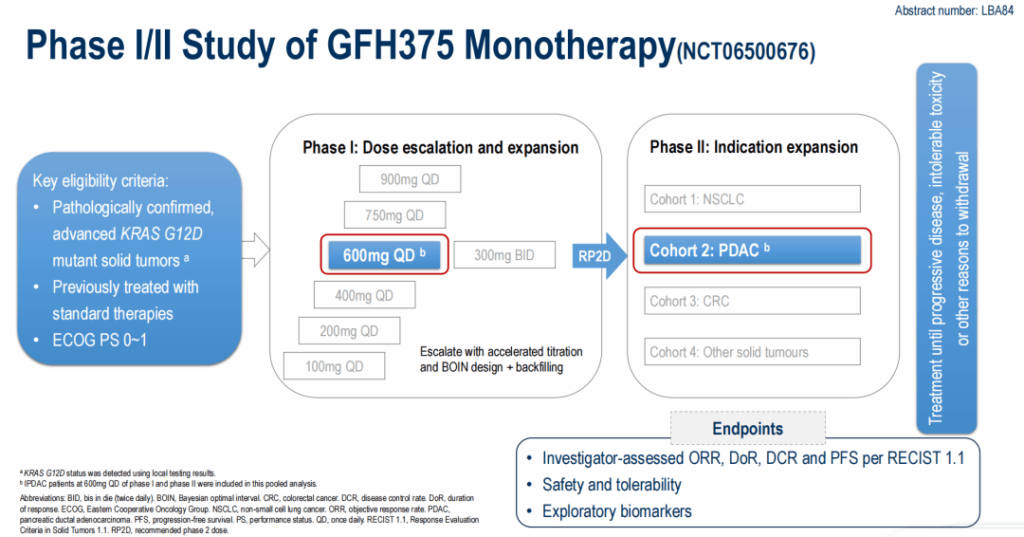
主要な適格基準には、進行または転移性PDAC、KRAS G12D変異の確認、前治療歴(多くの患者が複数の前治療を受けている)が含まれます。報告されたコホートの主要エンドポイントは、RECIST v1.1に基づく研究者評価のORR、DCR、奏効持続時間(DOR)、PFS、安全性と忍容性でした。探索的解析には、循環腫瘍DNA(ctDNA)プロファイリングと共発生ゲノム変異の評価が含まれました。
患者集団
データカットオフ日(2025年9月27日)時点で、66人のKRAS G12D変異進行PDAC患者がGFH375を投与されました。95.5%が登録時にステージIVでした。基線時の一般的な転移部位は肝臓(78.8%)、肺(28.8%)、腹膜(28.8%)でした。前治療は非常に多様で、68.2%が2つ以上の前治療を受け、33.3%が免疫チェックポイント阻害剤を含む前治療を受けました。解析時点では、31人(47.0%)が治療中でした。
主要な有効性結果
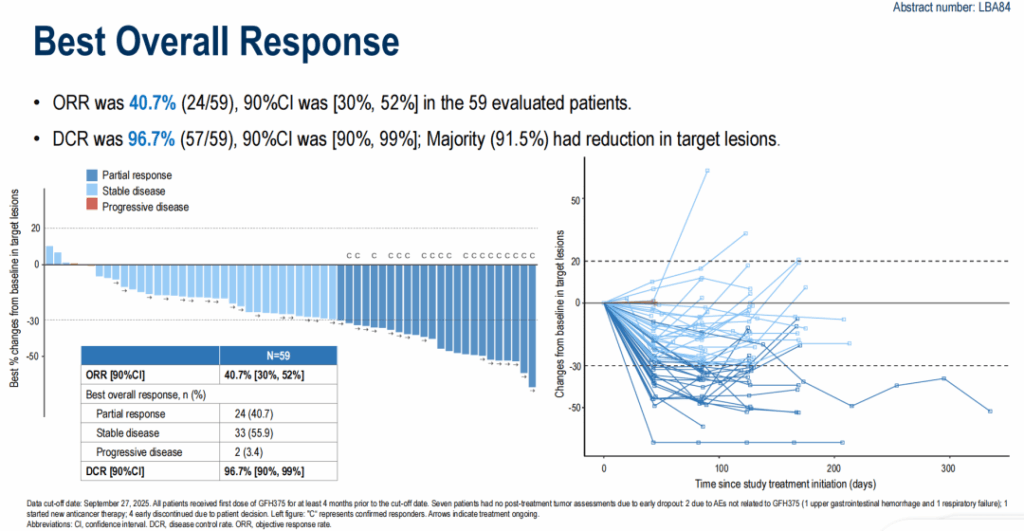
59人の評価可能な患者における研究者評価の反応は以下の通りでした:
- ORR: 40.7% (24/59) — 全て部分奏効(PR)。
- 安定病態(SD): 55.9% (33/59)。
- 進行病態(PD): 3.4% (2/59)。
- DCR: 96.7% (PR + SD)。
- 何らかの対象病変縮小の割合: 91.5%。
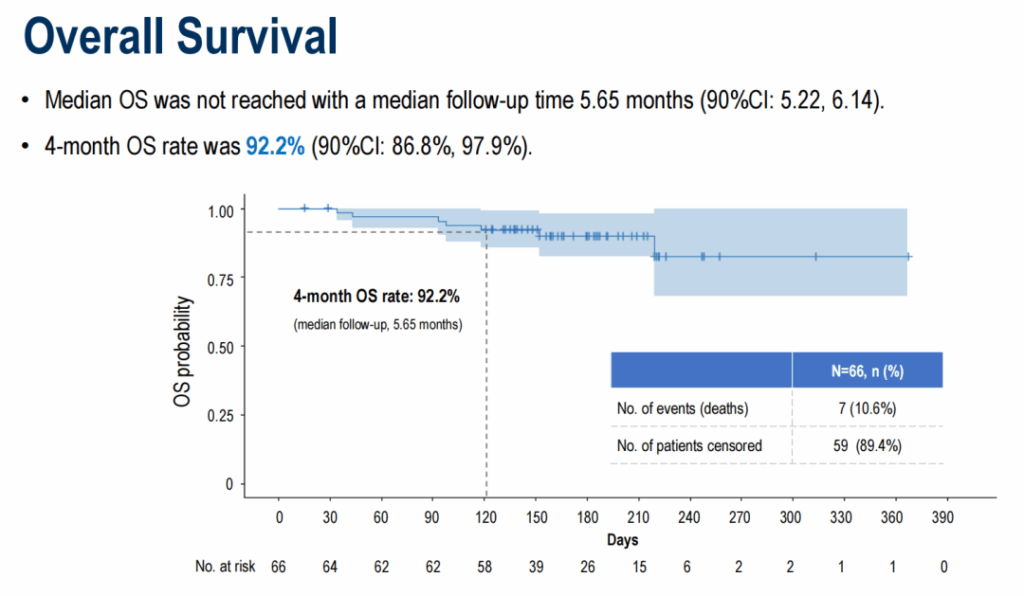
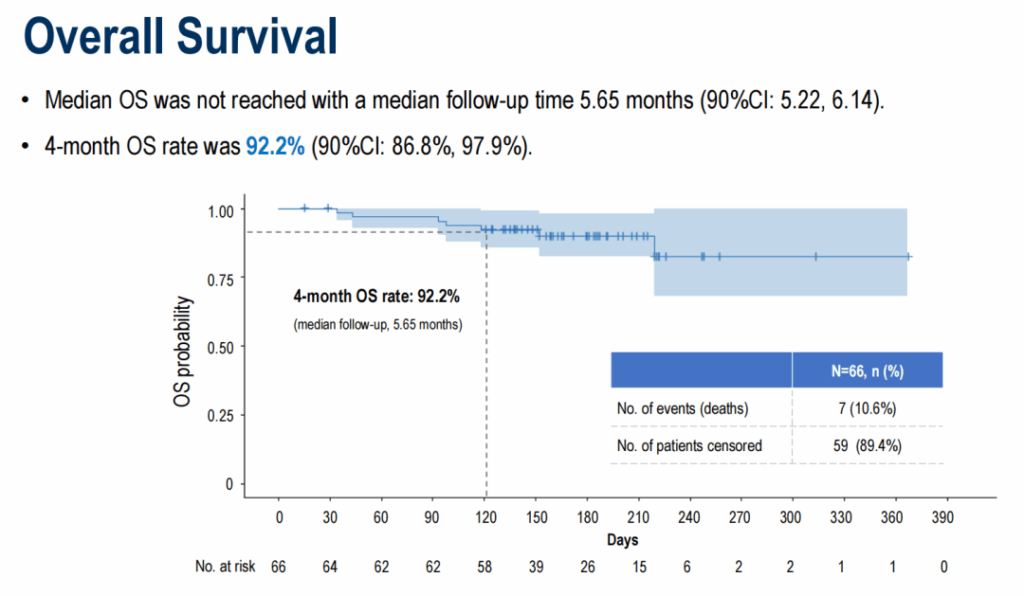
中央値追跡期間5.65ヶ月で、中央値PFSは5.52ヶ月(90%信頼区間 4.27–7.20)でした。4ヶ月PFS率は78.2%(90%信頼区間 69.8%–87.5%)でした。中央値OSは未達で、4ヶ月OS率は92.2%(90%信頼区間 86.8%–97.9%)でした。奏効持続時間データは報告時点で未成熟でした。
安全性と忍容性
GFH375治療は全患者(100%)で治療関連有害事象(TEAEs)を伴いました。ほとんどの治療関連有害事象(TRAEs)はグレード1–2で、主に消化器系または血液学的性質でした。グレード≧3のTEAEs/TRAEは31.8%(21人)に見られました。治療関連死亡例は報告されていません。研究者は、ほとんどの有害事象が支持療法と用量調整で管理可能であると指摘しました。詳細な有害事象の種類、発症時間、用量削減、中止などの完全な安全性データは、全文出版物で確認する必要があります。
バイオマーカー解析とサブグループ観察
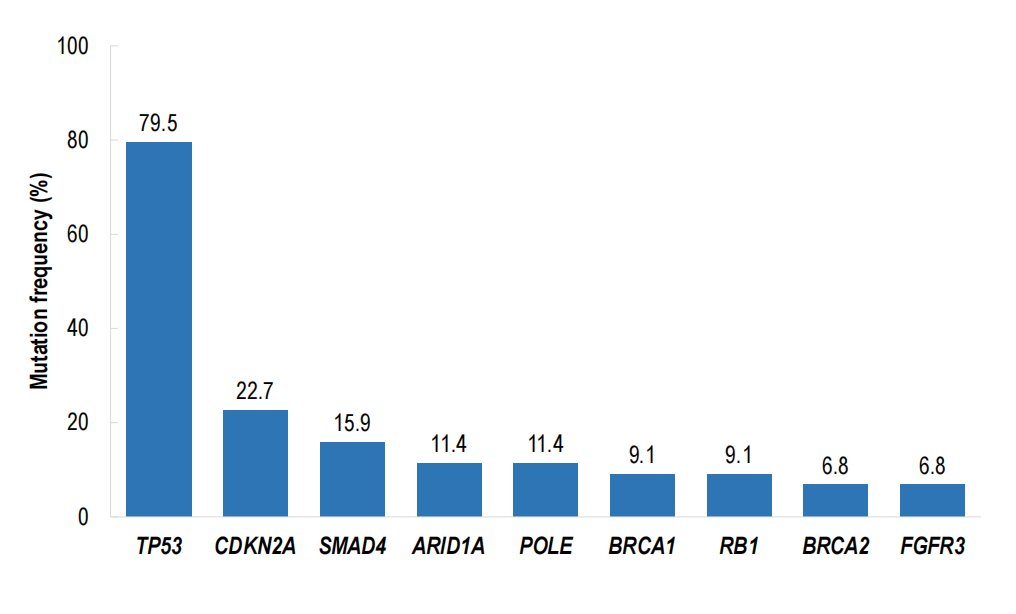
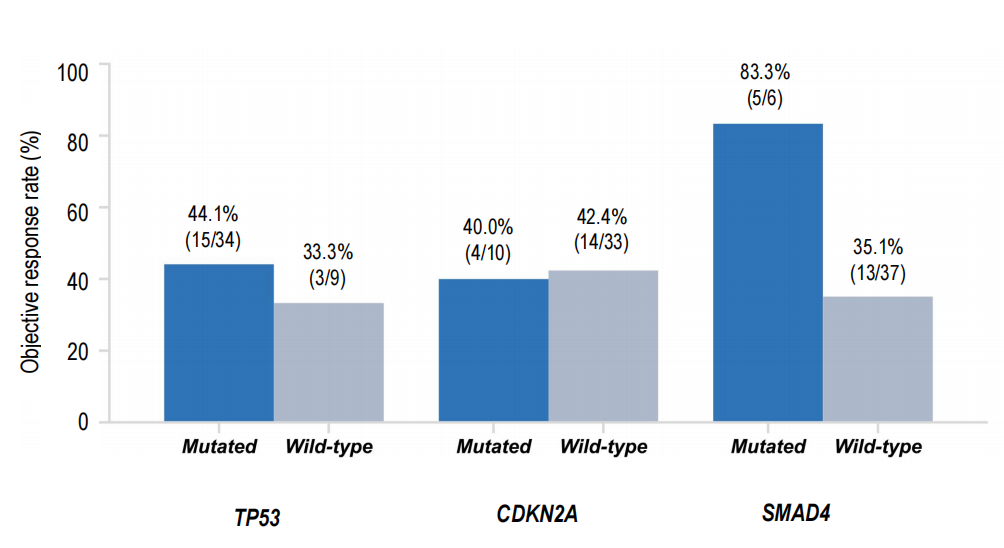
探索的なctDNA評価と共変異解析が報告されました。特に、TP53やSMAD4などのPDAC関連腫瘍抑制因子変異を有する患者でも反応が見られました。SMAD4共変異患者のサブグループで著しい信号が見られ、ORRは83.3%に達し、SMAD4野生型患者の35.1%と比較して有意差がありました。この知見は仮説生成的であり、サブグループサイズの小ささや潜在的な選択バイアスにより慎重な解釈が必要です。
解釈と臨床的文脈
これらの結果はいくつかの理由で注目されます。第一に、重篤な前治療歴を持つPDAC患者集団における単剤のORR 40.7%、DCR 96.7%は、この状況で伝統的に使用される後期線細胞障害療法で見られる典型的な奏効率よりも大幅に高いです。第二に、不利益な共変異プロファイルを持つ患者での効果の証拠は、KRAS G12D駆動疾患に対する広い治療窓を示唆しています。
メカニズム的には、GFH375は非共役阻害剤として記述されており、KRAS G12DのGDP結合(不活性)状態とGTP結合(活性)状態の両方を阻害し、下流効果子シグナルをブロックします。翻訳研究で確認されれば、双方向状態エンゲージメントは、一部の患者で観察された奏効の大きさと持続性を説明する助けになる可能性があります。
制限と注意点
重要な制限には、単群・非ランダム化設計、報告時点での比較的短い中央値追跡期間が含まれます。反応は研究者評価であり、独立した中央評価と成熟した生存エンドポイントが必要です。SMAD4共変異などの一部のゲノムサブグループの評価可能な患者数が少ないので、サブグループの有効性信号は探索的と考えるべきです。安全性追跡は継続中で、長期曝露により慢性毒性と遅延事象を定義する必要があります。
次のステップと継続的な開発
これらのデータに基づいて、KRAS G12D変異転移性PDACに対するGFH375と化学療法の比較を目的としたランダム化フェーズIII試験が2025年11月11日に登録され、公表されました。フェーズIII試験のデザイン、エンドポイント、適格基準は、フェーズI/IIで見られた信号が再現可能な生存利益となり、この分子的に定義されたサブグループに対する新しい標準治療となるかどうかを決定します。
専門家のコメント
GFH375は膵臓がんの精密腫瘍学における重要な進化を代表しています。KRASは長年にわたり「非薬理学的」と呼ばれ、G12C阻害剤の成功はKRAS標的化が可能であることを示しました。G12Dは異なる生化学的課題であり、PDACでより一般的ですが、GFH375の報告された臨床効果は特に注目に値します。
医師は慎重に楽観的であるべきです。フェーズIII結果がこれらの知見を確認すれば、KRAS G12D検査はPDAC管理の必須要素となり、GFH375は標準化学療法で進行した患者に対する生物学的に合理的で標的指向の経口オプションとなる可能性があります。一方、包括的なバイオマーカー研究、抵抗メカニズムのマッピング、化学療法、間質修飾剤、免疫療法との併用戦略などが優先され、最大限の利益を確保し、獲得抵抗性を克服する必要があります。
結論
ESMO 2025でのGFH375の発表は、重篤な前治療歴を持つPDAC患者集団で選択的、経口利用可能なKRAS G12D阻害が有意な腫瘍縮小と疾患制御をもたらし、管理可能な安全性プロファイルを持つことを示す有望な証拠を提供しています。これらの結果は、ランダム化試験での継続的な開発を支持し、PDACの日常的な分子プロファイリングの重要性を強調しています。これは、新規標的療法の恩恵を受ける可能性のある患者を特定するために必要です。
資金提供と試験登録
ここに議論されているフェーズI/II試験は、NCT06500676として登録されています。KRAS G12D変異転移性PDACに対するGFH375と化学療法の比較を目的としたランダム化フェーズIII試験は、2025年11月11日に登録され、公表されました。資金提供元はESMO抄録には詳細されていませんが、研究者は試験スポンサーからの支援を報告しています。完全な開示は、その後の査読付き出版物と規制申請で利用できます。
参考文献
1. Siegel RL, Giaquinto AN, Jemal A. Cancer statistics, 2024. CA Cancer J Clin. 2024;74(1):12-49.
2. Wu Y, He S, Cao M, et al. Comparative analysis of cancer statistics in China and the United States in 2024. Chin Med J (Engl). 2024;137(24):3093-3100.
3. Zhou A, Li Z, Sun Y, et al. Efficacy and safety of GFH375 monotherapy in previously treated advanced KRAS G12D mutant pancreatic ductal adenocarcinoma (PDAC). Presented at: 2025 ESMO Congress; October 17-21, 2025; Berlin, Germany. Abstract: LBA84.
4. Cox AD, Fesik SW, Kimmelman AC, Luo J, Der CJ. Drugging the undruggable RAS: progress and challenges. Nat Rev Drug Discov. 2014;13:828–51. (KRAS標的化の歴史的課題と進歩に関するレビュー)
読者への注意
この記事は、主要な腫瘍学会で発表された抄録の集約結果を要約しています。読者は、完全なデータ、更新された生存アウトカム、詳細な安全性情報が利用可能になった際には、査読付き論文、clinicaltrials.govエントリ、規制通信を参照することをお勧めします。