ハイライト
– 単回の硝子体注射で、ビオデグレーダブルアフリベセプト含有PLGAマイクロスフィア-温度応答性ヒドロゲルが23匹のマカクザルの硝子体内で24ヶ月間確認され、耐容性が良好でした。
– 眼圧、角膜厚さ、内皮細胞、軸長、屈折異常、網膜厚さ、網膜機能(ERG)、網膜/脈絡膜血管(FA)に一貫した悪影響は見られませんでした。
– 持続放出システムの可視化は9ヶ月間続きました;一部(7匹)の組織学的検査では網膜構造が保たれていました。
背景
硝子体内抗血管内皮成長因子(anti-VEGF)注射であるアフリベセプトは、新生血管性加齢黄斑変性(AMD)、糖尿病性網膜症などの網膜血管疾患の治療を変革しました。しかし、頻繁な注射は患者や医療システムにとって負担であり、手技的なリスクも伴います。投与間隔を減らしつつ効果と安全性を維持するためには、持続硝子体内薬物送達システム(DDS)が必要です。
ビオデグレーダブルポリマー微粒子(主にポリ(乳酸-コ-グリコール酸)、PLGA)とin situゲル化ヒドロゲルは、持続硝子体内放出を提供する戦略として研究されています。非人間霊長類(特にマカクザル)は、眼の解剖学と網膜の類似性から好ましい前臨床モデルであり、これらの動物での適合性と安全性データは、人間への翻訳に非常に有用です。
研究デザイン
この前臨床の安全性と適合性試験では、健康なマカクザルに対する新しいビオデグレーダブル注射可能なマイクロスフィア-ヒドロゲルDDSを評価しました。主な設計要素は以下の通りです:
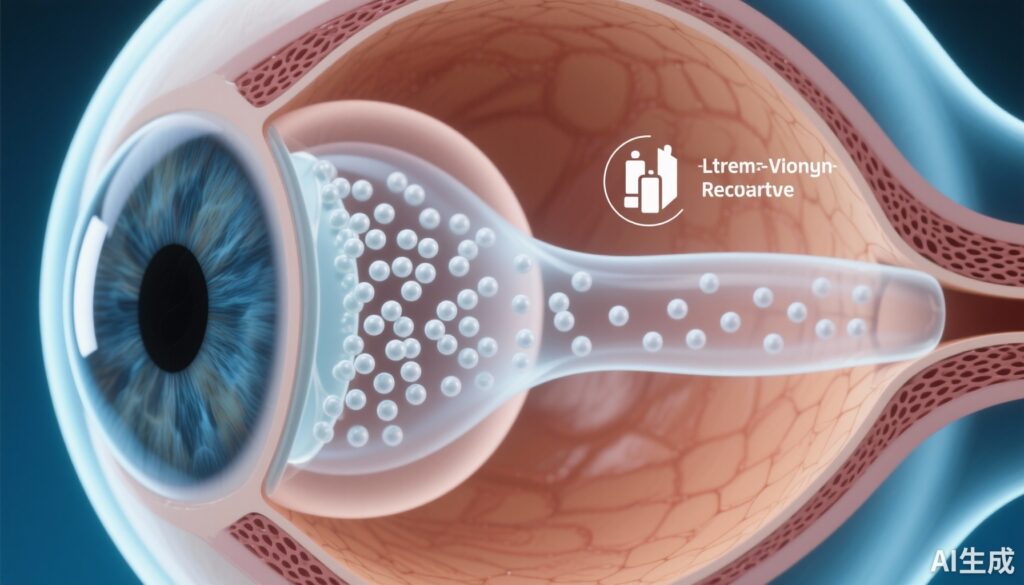
- 介入:改変された二重エマルション法で製造されたアフリベセプト含有PLGA微粒子が、温度応答性ポリ(エチレンギコール)-コ-(L-ラクチック酸)ジアクリレート/N-イソプロピルアクリルアミドヒドロゲル中に組み込まれています。
- 用量と投与:各動物の右眼に50 µLの硝子体内注射により15 µgのアフリベセプトを投与(n=23)。
- フォローアップ:月1回の包括的な眼科検査、眼圧(IOP)、角膜厚さ、顕微鏡検査、A-スキャンバイオメトリ、ストリークレティノスコピー、スペクトルドメイン光学干渉断層計(SD-OCT)、蛍光造影(FA)、電気生理学的検査(ERG)。一部(7匹)の眼球は組織学的検査を受けました。
- 評価項目:主な評価項目は、臨床的、構造的(OCT、FA)、機能的(ERG)、組織学的に24ヶ月間評価した局所眼耐容性と適合性でした。
主要な知見
持続放出システムの持続性と眼内可視性
硝子体内持続放出システム(アフリベセプト-DDS)は、注射後9ヶ月間硝子体内で可視化されました。23匹の目のうち4匹では底視が若干妨げられましたが、その他の目では臨床検査に支障はありませんでした。論文では持続放出システムの可視化が報告されていますが、硝子体または網膜内の定量的薬物動態放出曲線は提供されていません。
臨床的安全性と前部節の結果
一貫したまたは臨床上重要な前部節の有害事象は報告されていません。具体的には:
- 眼圧はすべての測定時間点で正常範囲内でした。
- 中央角膜厚さと内皮細胞密度(顕微鏡検査)は基準値と有意に異なりませんでした。
- 軸長と屈折異常(A-スキャンとレティノスコピーによる)は変化しませんでした。
網膜構造と血管の健全性
SD-OCTは、動物全体と時間点全体で正常な網膜構造が保たれていることを示し、総網膜厚さに有意な変化は見られませんでした。蛍光造影では、持続放出システムに起因する網膜または脈絡膜の血管異常(具体的には、漏出、非灌流、新生血管)は報告されていません。
網膜機能(ERG)
暗順応および明順応条件のフルフィールドERGは、混合ロッド-コーン反応やコーン反応の潜時や振幅に基準値/対照値と比較して有意な差は見られず、全網膜機能が保たれていることを示唆しています。
組織学的検査
7匹の眼球の組織学的検査では、網膜細胞構造が保たれており、持続放出システムに起因する一貫した炎症浸潤や毒性形態変化は見られませんでした。
観察期間
硝子体内持続放出システムは9ヶ月間可視化されましたが、安全性フォローアップは24ヶ月間続き、動物は一貫した構造的または機能的異常なしに過ごしました。
結果の解釈
これらの結果は、単回の硝子体内注射でテストされた用量において、このPLGAマイクロスフィア-ヒドロゲルDDSがアフリベセプトを運搬するプラットフォームが、非人間霊長類の眼で良好に耐容されることを示しています。網膜構造の保全(OCTと組織学的検査)、血管造影上の異常の欠如、安定したERG反応は、眼の適合性を支持する重要な前臨床信号です。
解釈の際の重要な注意点とニュアンスは以下の通りです:
- 本研究は健常眼で実施されました;疾患(例:AMD、糖尿病性網膜症)のある網膜では、炎症や異なる局所薬物動態に敏感である可能性があるため、これらの反応は評価されていません。
- 定量的薬物動態データ(例:眼内アフリベセプト濃度の経時変化)は報告されていません;持続放出システムの可視化が9ヶ月間続くことから持続放出が推測されますが、有効な治療レベルが直接定義されているわけではありません。
- テストされた単一用量(15 µg)は、一般的な臨床用量(例:人間では2 mg)よりも大幅に低いです;人間への翻訳には、用量スケーリングと用量反応が重要です。
- 組織学的検査のサンプルサイズ(7匹)は少なめです;一貫した悪性組織学的所見は見られませんでしたが、稀な事象を見逃す可能性があります。
専門家のコメントと文脈
持続硝子体内送達は、網膜疾患管理における主要な翻訳的優先課題です。現在の臨床戦略には、再充填可能な手術植込みポート(例:人間試験で研究されているランビズマブ送達システム)や様々な持続放出型生分解性製剤が含まれます。反復硝子体内注射や手術植込みを避けることができる生分解性、注射可能なプラットフォームは、最小侵襲的な投与、外来での投与の可能性、植込み物の除去や再充填手続きの排除という実用的な利点があります。
PLGAマイクロスフィアは、既知の生分解性と他の組織や薬物クラスでの規制 precedent により、最も研究されている生分解性キャリアの1つです。微粒子を温度応答性ヒドロゲル中に組み込むことで、微粒子の分散を制限し、局在化を促進し、放出速度を調節することができます。本研究では、眼内高血圧、内皮毒性、網膜構造損傷、機能障害が見られず、良好に設計されたPLGA/ヒドロゲルシステムの期待に沿っていますが、人間への翻訳には慎重な用量スケーリングと長期的安全性の確認が必要です。
制限と未解決の問題
- 疾患モデルと効力:健常非人間霊長類眼での安全性は必要ですが十分ではありません。将来の研究では、疾患モデル(または早期の人間試験)での薬物動態、機能的効力、安全性を評価し、臨床的に意味のある期間、眼内に有効なアフリベセプト濃度が持続するかどうかを確認する必要があります。
- 用量スケーリングと製剤:前臨床用量(15 µg)は、臨床用量(人間では2 mg)よりも大幅に低いです;制御された用量上昇と放出速度の最適化が必要です。
- 免疫原性と生分解産物:長期間の免疫応答、特にポリマー分解産物や製剤過程での可能なかたまり化タンパク質に対するもの、全身抗体形成や局所免疫モニタリングをさらに特徴付ける必要があります。
- 薬物動態:硝子体/網膜薬物濃度の経時変化に関するデータがないため、持続放出システムの可視化だけでは治療露出期間を決定することはできません。
- 画像や臨床ケアへの影響:持続放出システムが少数の目の底視を若干妨げたことは確認されていますが、OCT画像品質やレーザー処置など、臨床状況での網膜モニタリングへの潜在的影響を評価する必要があります。
翻訳的含意と次なるステップ
良好な非人間霊長類の安全性プロファイルは、薬物動態、用量最適化、効力の研究への進行を支持します。推奨される次のステップは以下の通りです:
- 眼内薬物濃度の経時変化を測定し、放出速度を定義し、持続放出システムの可視化と相関させる前臨床薬物動態研究。
- 用量上昇安全性研究と疾患モデル実験(例:マカクザルのレーザー誘発CNVや他の関連モデル)を行い、治療効果を試験し、用量を精緻化する。
- 反復曝露や持続放出後の免疫原性と抗薬物抗体のモニタリングを評価する。
- 慎重な安全性と効力評価、画像互換性評価、注射頻度の低減や視覚機能の安定化などの患者中心のアウトカムを含む、早期フェーズの人間臨床試験を行う。
結論
本研究は、単回の硝子体内注射後24ヶ月間にわたる構造的、機能的、組織学的評価により、新しいビオデグレーダブルPLGAマイクロスフィアを温度応答性ヒドロゲル中に埋め込み、アフリベセプトを載せたDDSが、健康なマカクザルの眼で良好に耐容されることを示しています。一貫した副作用は見られず、これらの前臨床安全性データは、網膜疾患の治療負担を軽減する持続硝子体内anti-VEGF送達戦略の薬物動態、効力、翻訳開発へのさらなる発展を支持しています。
資金提供とclinicaltrials.gov
具体的な資金提供の開示と利益相反については、公開論文を参照してください(Story BD et al., Drug Deliv. 2025)。前臨床報告にはclinicaltrials.govの識別子は提供されていません;その後の人間試験には登録が必要です。
参考文献
1. Story BD, Park S, Roszak K, Shim J, Motta M, Ferneding M, Rudeen KM, Blandino A, Ardon M, Le S, Teixeira LBC, Yiu G, Mieler WF, Thomasy SM, Kang-Mieler JJ. Safety and biocompatibility of a novel biodegradable aflibercept-drug delivery system in rhesus macaques. Drug Deliv. 2025 Dec;32(1):2460671. doi: 10.1080/10717544.2025.2460671. Epub 2025 Mar 4. PMID: 40038090; PMCID: PMC11884103.
2. Danhier F, Ansorena E, Silva JM, Coco R, Le Breton A, Préat V. PLGA-based nanoparticles: an overview of biomedical applications. J Control Release. 2012 Jul 20;161(2):505–522. doi:10.1016/j.jconrel.2012.01.043.
3. Heier JS, Brown DM, Chong V, Korobelnik J-F, Kaiser PK, Nguyen QD, et al. Intravitreal aflibercept (VEGF Trap-Eye) in wet age-related macular degeneration. Ophthalmology. 2012;119(12):2537–2548. (VIEW1 and VIEW2 pooled analyses).
AIサムネイルプロンプト
人間の眼の断面を高精細に描いた医療イラストで、硝子体腔内に透明なヒドロゲル中に埋め込まれた小さな生分解性微粒子からなる硝子体内持続放出システムを示します。’アフリベセプト’、’持続放出’のタイムラインバー、そしてイラストの背景に保たれた網膜/黄斑部の層を表示します。クリーンな臨床色調、現実的な解剖学的テクスチャ、そして落ち着いた臨床的なトーンで描かれています。