はじめに
脳卒中は世界中で死亡と障害の主な原因であり、特に糖尿病患者に影響を与えています。特に、糖尿病の一般的な微小血管合併症である糖尿病末梢神経障害(DPN)は、虚血性脳卒中のリスク増加と関連していることが示されています。しかし、DPNと脳卒中のサブタイプを結ぶ具体的な病因パターンは不明です。DPNが特定の虚血性脳卒中メカニズム、例えば脳小血管病変(SVD)を予測するかどうかを理解することは、標的を絞った予防戦略と糖尿病患者の脳血管リスク管理の改善の可能性を持っています。
研究デザインと方法
2020年1月から2023年12月まで、フランスギアナのアンデ・ローズモン中央病院で虚血性脳卒中で入院した226人の患者を対象とした後ろ向き観察コホート研究が実施されました。患者の選択は、脳卒中のICD10コードに基づいて行われました。DPNの診断は、国際糖尿病足部作業部会(IWGDF)の基準を使用して内分泌科医が行ったもので、単一フィラメントテスト、足首反射、振動閾値評価が含まれています。
主要エンドポイントは、ASCOD分類システム(動脈硬化、小血管病変、心臓疾患、その他の原因、解離)に基づくDPNと脳卒中の病因との関連を特定することでした。二次エンドポイントでは、DPNと年齢、性別、脳卒中の重症度(NIHSSおよびmRSスコア)、再発、1年間の死亡率の関係を評価しました。統計解析には、単変量および多変量ロジスティック回帰が使用され、オッズ比(OR)および調整オッズ比(aOR)が算出されました。
主要な知見
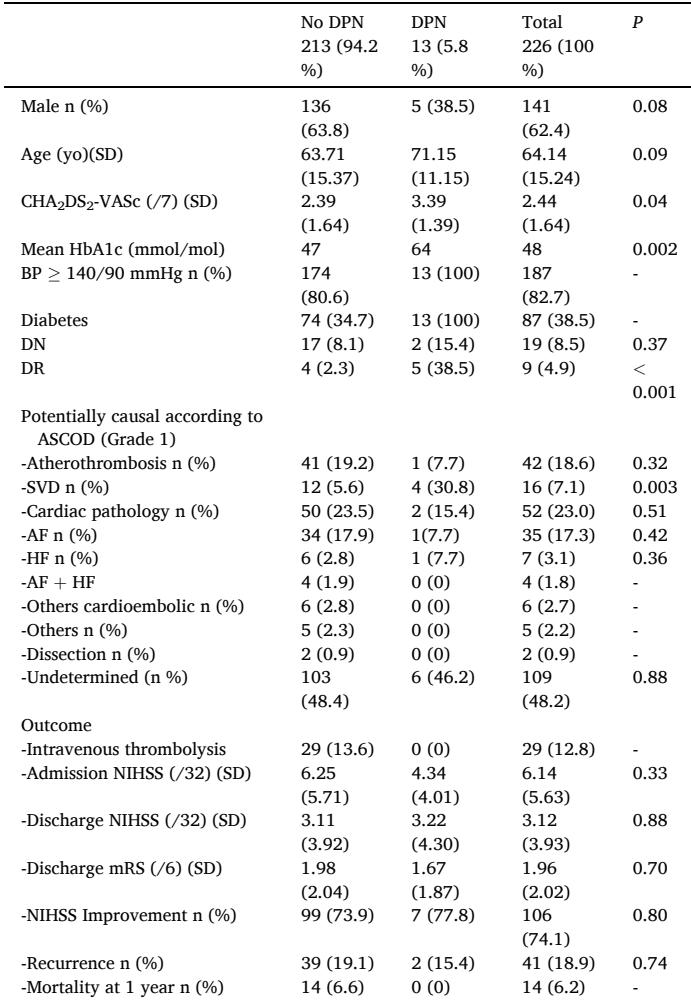
このコホートの平均年齢は64.14歳で、男性が62.4%を占めました。全体の5.8%の患者にDPNが見られ、糖尿病患者の14.9%を占めていました。DPNの有病率は女性で高く、HbA1cとCHA2DS2-VAScスコアが高かったことから、心血管リスク負荷が大きいことが示されました。
重要な点は、DPNがSVDによる虚血性脳卒中と有意に関連していたことです。調整前のORは7.44(95% CI 2.00–27.70)で、混雑因子を調整した後もaOR 5.08(95% CI 1.17–22.14)で有意な関連が維持されました。DPNのある患者におけるSVD脳卒中の寄与率は86.6%で、集団寄与率は21.6%と推定されました。これにより、DPNが微小血管脳病変の指標としての重要性が強調されます。DPNと他の脳卒中病因との有意な関連は見られず、脳卒中の重症度、再発、1年間の死亡率ともに有意な関連は見られませんでした。
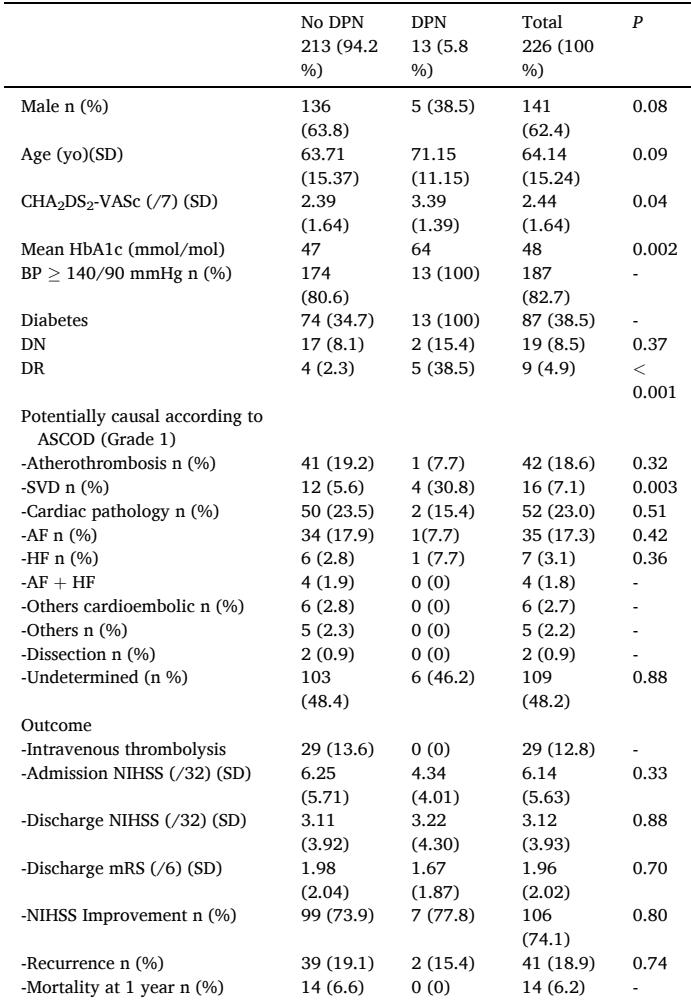
Table 3. Multivariate analysis of factors associated with small vessel disease.
| Empty Cell | SVD aOR (CI 95) |
|---|---|
| Age 60 yo | 0.98 (0.82;1.18) |
| Male | 0.48 (0.16;1.47) |
| CHA2DS2-VASc2 | 5.45 (0.63;47.10) |
| Diabetes | 0.98 (0.29;3.42) |
| DPN | 5.98 (1.17;22.14) |
Table 4. Factors associated with all phenotypes of small-vessel disease.
| All phenotypes of SVD n = 39 | OR (CI 95) | aOR (CI 95) |
|---|---|---|
| Age ≥ 60 yo | 0.98 (0.89;1.09) | 0.98 (0.87;1.10) |
| Male | 0.84 (0.42;1.70) | 0.87 (0.41;1.83) |
| CHA2DS2-VASc ≥ 2 | 0.70 (0.34;1.44) | |
| BP ≥ 140/90 mmHg | 2.86 (0.83;9.81) | |
| Diabetes | 1.00 (0.49;2.03) | 0.64 (0.27;1.48) |
| DPN | 4.67 (1.47;14.79) | 6.19 (1.70;22.58) |
| DN | 1.79 (0.60;5.29) | |
| DR | 2.53 (0.60;10.71) |
討論と専門家のコメント
この研究の結果は、DPNが糖尿病脳卒中患者における脳SVDの強い臨床マーカーであることを示す強力な証拠を提供しています。これは、両条件における微小血管障害の共有病理生理学的特徴と一致しています。DPNに内在する微小血管損傷は、ラクナー梗塞で見られる脳小血管変化と並行しています。
SVDはラクナー脳卒中だけでなく、血管性認知障害や認知症にも寄与するため、血糖制御、高血圧、その他の修正可能なリスク要因を対象とした予防介入の貴重な窓口として、早期のDPN識別が提供されます。脳卒中患者におけるDPNの有病率は以前の疫学データと一致していましたが、無症状の神経障害のために後ろ向き評価が真の有病率を過小評価する可能性があります。
メカニズム的には、高血糖誘導経路—AGE、ポリオール経路、プロテインキナーゼC活性化—ならびに酸化ストレスとミトコンドリア機能不全が、DPNとSVDの両方で神経線維損傷と微小血管内皮損傷に寄与します。全身的な代謝障害と微小血管障害の相互作用は、「糖尿病全血管病」という概念を強化し、末梢と脳の微小血管障害を統合します。
制限点には、後ろ向きデザインと、すべての脳卒中患者での神経学的評価が不完全であるためDPNの診断が不足している可能性があります。さらに、因果関係を確立することは困難であり、標準化されたDPN評価と長期追跡を含む前向き研究が必要です。
結論
糖尿病末梢神経障害は、糖尿病患者の脳小血管病変とラクナー脳卒中と有意に関連しています。DPNは、微小血管脳虚血イベントのリスクが高い個人を特定する実用的な臨床マーカーとして機能し、早期かつ標的を絞った予防戦略を可能にします。糖尿病ケアに包括的な神経障害評価を組み込むことで、脳血管リスク層別化が改善され、この脆弱な人口集団における脳卒中負担が最終的に軽減される可能性があります。
参考文献
- Feigin VL, Stark BA, CO J, Roth GA, Bisignano C, Abady GG, et al. 1990年から2019年までの世界的、地域的、国家別の脳卒中とそのリスク要因の負担:GBDスタディ2019の系統的分析. Lancet Neurol. 2021;20(7):795-820.
- Amarenco P, Bogousslavsky J, Caplan LR, Donnan GA, Wolf ME, Hennerici MG. 虚血性脳卒中のASCOD現型(更新版ASCOD現型). Cerebrovasc Dis. 2013;36(1):1-5.
- Brownrigg JRW, De Lusignan S, McGovern A, et al. 糖尿病末梢神経障害と2型糖尿病における心血管イベントのリスク. Heart. 2014;100(23):1837-43.
- Selvarajah D, Kar D, Khunti K, et al. 糖尿病末梢神経障害:診断の進歩とスクリーニングおよび早期介入の戦略. Lancet Diabetes Endocrinol. 2019;7(12):938-948.