Giới thiệu
Quản lý viêm da mề đay mãn tính tự phát (CSU) đã là thách thức đối với các bác sĩ, đặc biệt khi các phương pháp điều trị chuẩn không cung cấp đủ sự giảm nhẹ. Được đặc trưng bởi sự xuất hiện đột ngột của các nốt ngứa, phù mạch hoặc cả hai kéo dài sáu tuần trở lên, CSU ảnh hưởng nghiêm trọng đến chất lượng cuộc sống, giấc ngủ và sức khỏe tinh thần. Mặc dù kháng histamin thế hệ thứ hai (H1-AH) là phương pháp điều trị đầu tiên, nhưng lên đến 50% bệnh nhân vẫn có triệu chứng ngay cả khi dùng liều gấp bốn lần. Đối với những bệnh nhân này, phạm vi điều trị đã khá hẹp. Tuy nhiên, các kết quả gần đây từ chương trình thử nghiệm lâm sàng giai đoạn 3 LIBERTY-CSU CUPID, cụ thể là nghiên cứu CUPID-C và phân tích tổng hợp, cho thấy rằng dupilumab – một kháng thể đơn dòng nhắm vào đường tín hiệu IL-4/IL-13 – mang lại bước đột phá đáng kể cho những bệnh nhân chưa từng sử dụng kháng IgE và không kiểm soát được bằng kháng histamin.
Tóm tắt
Các điểm sau đây tóm tắt những nhận xét chính từ thử nghiệm CUPID-C và phân tích tổng hợp:
Hiệu quả trong CSU không đáp ứng
Dupilumab giảm đáng kể mức độ ngứa và mẩn đỏ ở bệnh nhân vẫn có triệu chứng mặc dù đã điều trị bằng kháng histamin tiêu chuẩn hoặc liều cao.
Xác nhận các kết quả trước đó
Thử nghiệm CUPID-C đã tái tạo thành công các kết quả tích cực của thử nghiệm CUPID-A trước đó, đáp ứng tất cả các tiêu chí chính và phụ quan trọng để xem xét quy định.
In ức chế loại 2 có mục tiêu
Nghiên cứu này khẳng định vai trò của viêm loại 2 (được trung gian bởi IL-4 và IL-13) trong cơ chế bệnh sinh của CSU, mở rộng khả năng lâm sàng của dupilumab vượt ra ngoài hen suyễn và viêm da dị ứng.
Hồ sơ an toàn thuận lợi
Kết quả an toàn phù hợp với hồ sơ đã được xác lập của dupilumab, với tỷ lệ tác dụng phụ tương đương với nhóm giả dược.
Nền tảng: Gánh nặng và cơ chế bệnh sinh của CSU
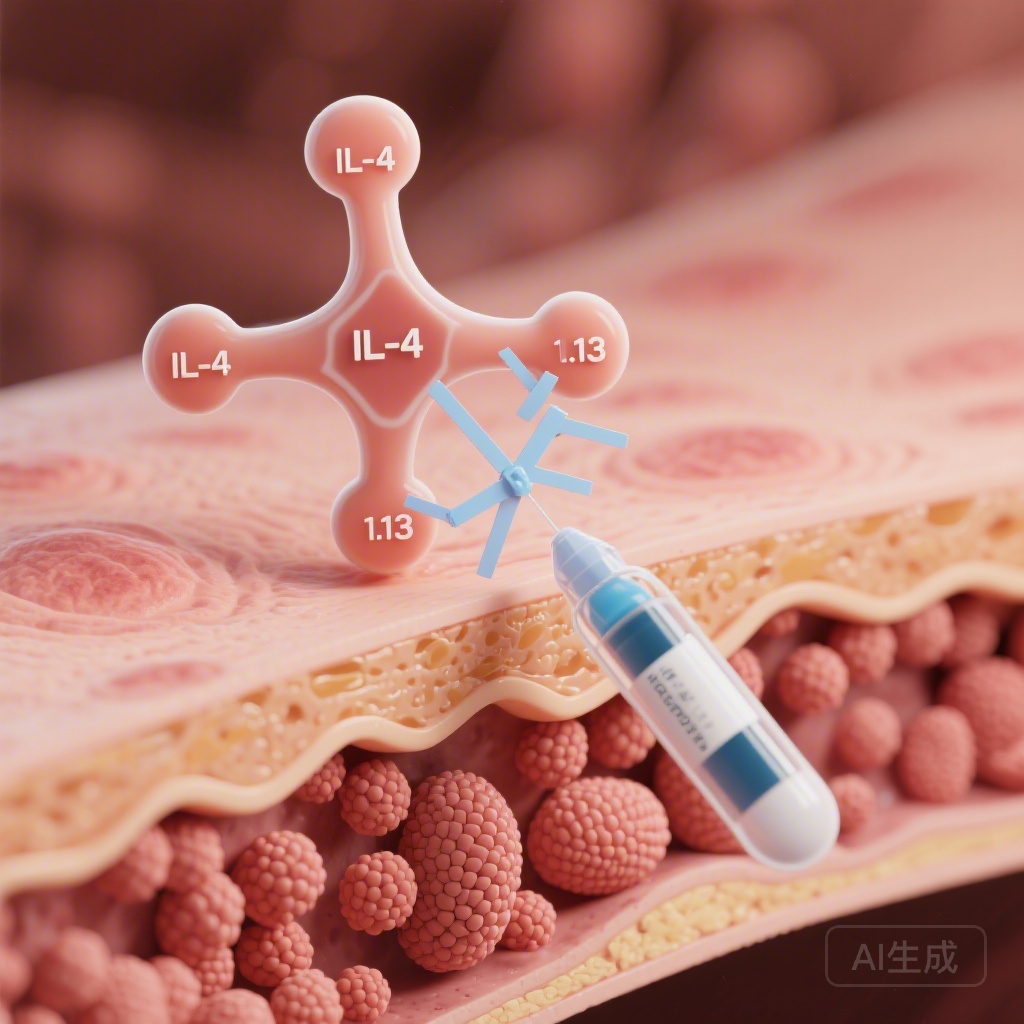
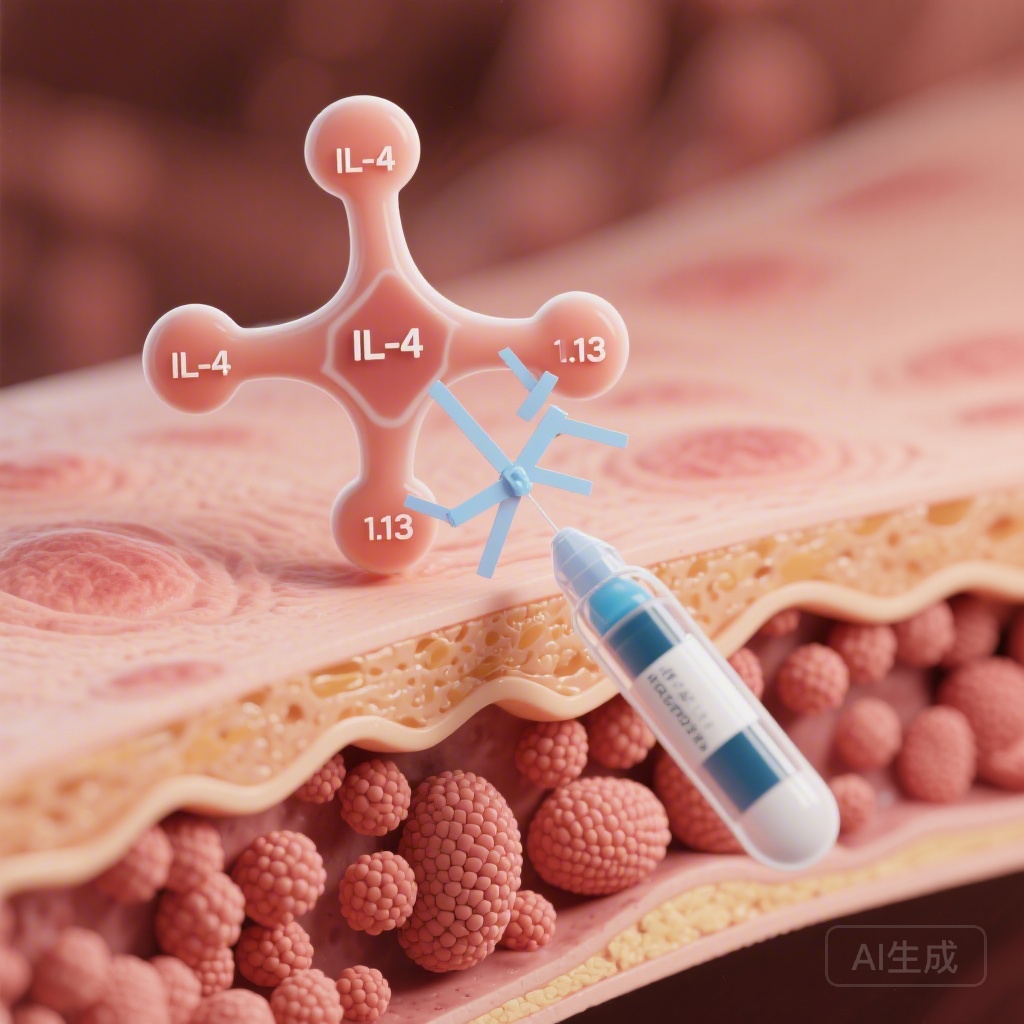
CSU không chỉ là một tình trạng da; nó là một bệnh viêm hệ thống với gánh nặng tâm lý xã hội sâu sắc. Hiểu biết truyền thống về CSU tập trung vào việc kích hoạt các tế bào mast và basophil, dẫn đến giải phóng histamin và các chất trung gian viêm khác. Sự kích hoạt này thường do các cơ chế tự miễn, bao gồm tự miễn loại I (trung gian bởi IgE) và tự miễn loại IIb (trung gian bởi IgG).Các hướng dẫn quốc tế hiện hành, như của EAACI/GA²LEN/EuroGuiDerm/APAAACI, khuyến nghị tiếp cận theo từng bước, bắt đầu bằng H1-AH. Khi các phương pháp này thất bại, omalizumab (một kháng thể chống IgE) thường là bước tiếp theo. Tuy nhiên, khả năng tiếp cận omalizumab và phản ứng đa dạng của bệnh nhân để lại một khoảng trống lâm sàng. Việc khám phá dupilumab trong lĩnh vực này dựa trên quan sát rằng IL-4 và IL-13 góp phần vào việc sản xuất IgE và tuyển dụng, nhạy cảm hóa các tế bào viêm trong da. Bằng cách chặn tiểu đơn vị thụ thể IL-4 chung (IL-4Rα), dupilumab ngắt tín hiệu của cả hai cytokine, có thể ổn định môi trường viêm gây ra mề đay.
Thiết kế nghiên cứu: Chương trình LIBERTY-CSU CUPID
LIBERTY-CSU CUPID-C (NCT04180488) là một thử nghiệm lâm sàng giai đoạn 3 ngẫu nhiên, giả dược, mù đôi, kéo dài 24 tuần. Nó được thiết kế để sao chép thử nghiệm CUPID-A nhằm đáp ứng yêu cầu của Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) về bằng chứng hiệu quả và an toàn.
Đặc điểm dân số và tiêu chí bao gồm
Thử nghiệm đã tuyển chọn 151 người tham gia từ 10 quốc gia. Tiêu chí bao gồm tập trung vào bệnh nhân từ 6 đến 80 tuổi có CSU không kiểm soát được bằng H1-AH. Đáng chú ý, tất cả người tham gia đều chưa từng sử dụng liệu pháp chống IgE (omalizumab). Tại thời điểm cơ bản, hơn 50% nhóm có liều kháng histamin cao hơn so với khuyến cáo, và gần 60% có điểm số Hoạt động Mề Đay trong 7 ngày (UAS7) cơ bản là 28 hoặc cao hơn, chỉ ra mức độ hoạt động bệnh cao.
Can thiệp và tiêu chí đánh giá
Người tham gia được ngẫu nhiên hóa để nhận dupilumab (300 mg mỗi hai tuần cho người lớn, với liều dựa trên cân nặng cho trẻ em) hoặc giả dược tương ứng trong 24 tuần. Các tiêu chí chính là sự thay đổi từ cơ bản đến tuần 24 trong Điểm Số Nặng Nề Ngứa trong 7 ngày (ISS7) và UAS7. Đây là các công cụ đã được xác nhận để đo mức độ nghiêm trọng của bệnh do người bệnh báo cáo, với điểm số cao hơn phản ánh mức độ ngứa mạnh hơn và số lượng nốt mẩn nhiều hơn.
Kết quả chính: Giảm đáng kể mức độ hoạt động bệnh
Các kết quả từ CUPID-C và phân tích tổng hợp với CUPID-A cung cấp bằng chứng vững chắc về lợi ích lâm sàng của dupilumab.
Kết quả CUPID-C
Trong thử nghiệm CUPID-C, dupilumab thể hiện sự vượt trội thống kê so với giả dược. Đối với ISS7, sự thay đổi trung bình bình phương (LS) từ cơ bản là -8.64 cho nhóm dupilumab so với -6.10 cho nhóm giả dược, đại diện cho sự khác biệt về điều trị là -2.54 (KTC 95%, -4.65 đến -0.43; P = .02). Tương tự, đối với UAS7, sự thay đổi LS trung bình là -15.86 cho dupilumab so với -11.21 cho giả dược, sự khác biệt là -4.65 (KTC 95%, -8.65 đến -0.65; P = .02).
Phân tích tổng hợp (CUPID-A và CUPID-C)
Khi dữ liệu từ cả hai thử nghiệm (tổng cộng 289 người tham gia) được kết hợp, mức độ hiệu ứng trở nên rõ ràng hơn. Phân tích tổng hợp cho thấy cải thiện nhất quán và vững chắc về mức độ ngứa và mẩn đỏ trên các vùng địa lý và nhóm tuổi khác nhau. Sự nhất quán này cho thấy hiệu quả điều trị của dupilumab trong CSU là đáng tin cậy và có thể lặp lại.
Tiêu chí phụ
Bên cạnh các điểm số chính, bệnh nhân được điều trị bằng dupilumab báo cáo chất lượng cuộc sống tốt hơn và khả năng đạt được kiểm soát hoàn toàn hoặc gần hoàn toàn các triệu chứng cao hơn so với nhóm giả dược. Những kết quả trung tâm này là quan trọng trong quản lý CSU, nơi trải nghiệm chủ quan của ngứa là nguyên nhân chính của khuyết tật.
An toàn và khả năng dung nạp
An toàn là mối quan tâm hàng đầu khi giới thiệu các liệu pháp sinh học. Trong phân tích tổng hợp, 53.5% bệnh nhân trong nhóm dupilumab báo cáo các sự cố bất lợi xuất hiện trong quá trình điều trị (TEAEs), so với 55.9% trong nhóm giả dược. Hầu hết các sự cố đều nhẹ đến trung bình. Các TEAEs phổ biến nhất bao gồm phản ứng tại chỗ tiêm và đau đầu, phù hợp với hồ sơ an toàn đã biết của dupilumab trong các chỉ định khác như hen suyễn và viêm da dị ứng. Không có tín hiệu an toàn mới hoặc bất ngờ, khẳng định rằng dupilumab là một lựa chọn dung nạp tốt cho quản lý lâu dài CSU.
Bình luận chuyên gia: Nhìn nhận cơ chế và tác động lâm sàng
Thành công của chương trình CUPID có ý nghĩa quan trọng đối với hiểu biết của chúng ta về CSU. Lịch sử, CSU được xem chủ yếu thông qua góc nhìn của histamin và IgE. Tuy nhiên, hiệu quả của một chất ức chế IL-4/IL-13 nhấn mạnh sự phức tạp của cảnh quan miễn dịch của bệnh. Bằng cách giảm môi trường do Th2, dupilumab có thể không chỉ giảm mức độ IgE theo thời gian mà còn giảm độ nhạy của tế bào mast đối với các tác nhân khác nhau.Từ góc độ lâm sàng, các kết quả này cho thấy dupilumab có thể đóng vai trò là một lựa chọn thay thế hoặc bổ sung quý giá cho thuật toán điều trị hiện tại. Mặc dù omalizumab vẫn là trụ cột của điều trị, có một chất sinh học thứ hai với cơ chế tác động khác biệt là thiết yếu cho y học cá nhân hóa. Ví dụ, bệnh nhân có các bệnh đồng mắc như hen suyễn hoặc viêm da dị ứng – cả hai đều đáp ứng với dupilumab – có thể đặc biệt hưởng lợi từ cách tiếp cận này.Một hạn chế được các chuyên gia lưu ý là việc loại trừ các bệnh nhân đã từng thất bại với omalizumab trong các phân tích thử nghiệm cụ thể này (CUPID-A và C). Mặc dù một thử nghiệm riêng (CUPID-B) đã điều tra dân số cụ thể này, các kết quả được thảo luận ở đây chỉ áp dụng cho những người chưa từng sử dụng kháng IgE. Nghiên cứu trong tương lai nên tiếp tục khám phá các dấu hiệu sinh học có thể dự đoán bệnh nhân nào sẽ đáp ứng tốt nhất với ức chế IL-4/IL-13 so với liệu pháp chống IgE.
Kết luận
Thử nghiệm LIBERTY-CSU CUPID-C, cùng với dữ liệu tổng hợp từ CUPID-A, cung cấp bằng chứng cấp cao rằng dupilumab là một phương pháp điều trị hiệu quả và an toàn cho bệnh nhân mắc viêm da mề đay mãn tính tự phát không kiểm soát được bằng kháng histamin. Bằng cách giảm đáng kể gánh nặng ngứa và mẩn đỏ, dupilumab giải quyết một nhu cầu chưa được đáp ứng lớn trong cộng đồng da liễu và dị ứng. Khi các cơ quan quản lý xem xét các dữ liệu này, các bác sĩ có thể mong đợi sự mở rộng tiềm năng của bộ công cụ điều trị, mang lại hy vọng mới cho bệnh nhân đang đối mặt với những thách thức hàng ngày của CSU.
Tài trợ và Đăng ký Lâm sàng
Chương trình thử nghiệm lâm sàng LIBERTY-CSU được tài trợ bởi Sanofi và Regeneron Pharmaceuticals. Thử nghiệm được đăng ký tại ClinicalTrials.gov dưới số hiệu NCT04180488.
Tham khảo
Casale TB, Saini SS, Ben-Shoshan M, Giménez-Arnau AM, Bernstein JA, Hayama K, Amin N, Robinson LB, Bauer D, Dakin P, Laws E, Radin A, Makhija M. Dupilumab in Patients With Chronic Spontaneous Urticaria: Phase 3 LIBERTY-CSU CUPID Randomized Clinical Trials. JAMA Dermatol. 2026 Feb 18:e256023. doi: 10.1001/jamadermatol.2025.6023. Epub ahead of print. PMID: 41706458; PMCID: PMC12917742.