はじめに
大腸がん肝転移(CRLM)は、初期診断時に約80%の患者が腫瘍負荷の広範性や重要な病変部位により手術不能であるという重大な臨床的課題を呈しています。全身誘導化学療法は、腫瘍の縮小を目指し、二次的な局所的介入の可能性を高めるか、または緩和的な状況で生存期間を延長することを目的としています。現在、腫瘍反応評価は主にRECIST1.1基準に基づいて行われており、これは各臓器の最大2つの対象病変の最長径の変化を測定します。しかし、RECIST1.1には再現性の低さや全体的な腫瘍負荷の表現不足など、顕著な欠点があります。これは、すべての転移巣の体積変化を無視しているためです。画像技術と深層学習の進歩により、総腫瘍体積(TTV)の体積評価が可能となり、予備データではRECIST1.1よりも予後予測が優れていることが示されています。しかし、全身誘導療法を受けている患者におけるTTVの臨床的妥当性、汎用性、予測能力はまだ明確ではありません。
研究デザインと方法
本付随研究では、第3相CAIRO5試験(NCT02162563)のデータを分析し、当初手術不能であった肝単独のCRLM患者425人を対象としました。これらの患者は、原発腫瘍の位置とRAS/BRAF変異の有無に基づいて無作為に割り付けられ、FOLFOX-/FOLFIRI-bevacizumab、FOLFOXIRI-bevacizumab、またはFOLFOX-/FOLFIRI-panitumumabを含む全身療法を受けました。治療前と最初のフォローアップでのコントラスト強化CTスキャンを使用し、専門放射線技師によって検証された半自動体積セグメンテーション手法により、基準時と治療後のTTVを定量しました。RECIST1.1評価(直径の合計と反応の分類)は専門家パネルによって実施されました。主要エンドポイントは全生存期間(OS)であり、統計解析には多変量Cox回帰モデルと柔軟なパラメトリック生存モデルを使用し、TTVとRECIST1.1の予後予測能力を評価しました。
主要な知見
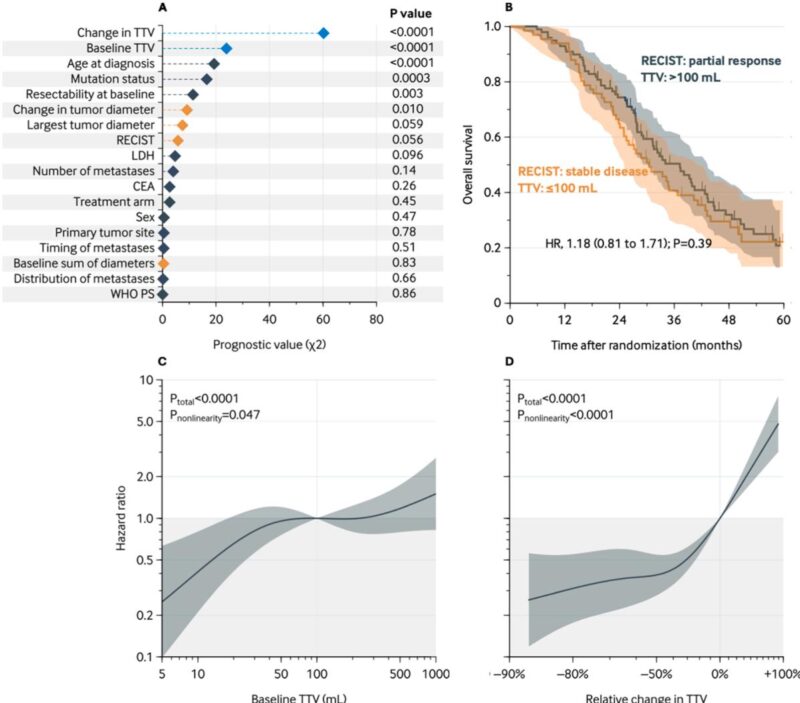
基準時の中央値TTVは103 mL(四分位範囲:25–409 mL)、治療後の相対的な腫瘍体積減少の中央値は51%でした。特に、TTVとその相対的な変化は、OSの最も強い独立予測因子でした(調整ハザード比[aHR]:基準時TTV 100 mL vs 10 mL:2.44;95%信頼区間[CI]:1.25–4.76;P=0.006;TTV 0% vs 50%減少:2.57;95%CI:1.83–3.60;P<0.0001)。対照的に、RECIST1.1反応カテゴリーはOSとの独立した関連性を示しませんでした(aHR部分奏効 vs 病勢進行:0.63;95%CI:0.33–1.20)。部分奏効かつ基準時TTVが高い患者のOSは、安定病変かつ基準時TTVが低い患者と同等であり、TTVが提供する優れた予後予測力が強調されました。
さらに、TTV測定値と生存期間の非線形関係が観察されました。基準時TTVが100 mLの場合、5 mLと比較してOSが大幅に悪化することが確認されましたが、100 mLを超えるとリスクが頭打ちとなりました。同様に、TTVの減少による生存利益は約50%の減少まで有意であり、その後は効果が逓減しました。特に、基準時TTVとTTVの変化を臨床変数に組み込むことで、OS予測が改善し、C統計量が0.71から0.75に上昇しました(P=0.002)。
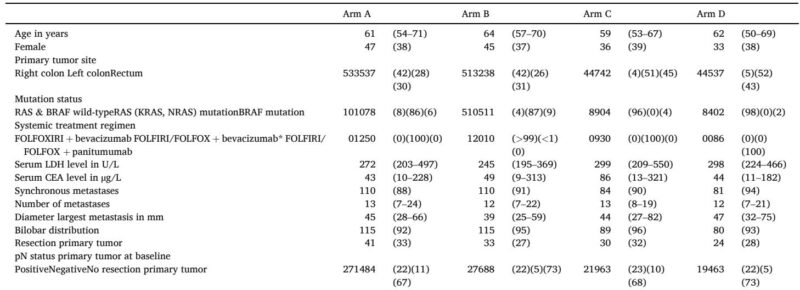
予測解析では、基準時TTVが高いほど、左側原発腫瘍を持つRAS/BRAF野生型患者において、FOLFOX-/FOLFIRI-bevacizumabがpanitumumabよりも大きなOS利益をもたらすことが示されました(P相互作用=0.017)。例えば、基準時TTVが3 mLの場合は、panitumumabが5年生存率(60% vs 29%)で優れていましたが、2000 mLの場合はbevacizumabが優れていました(24%の生存利益)。右側原発腫瘍または変異のある腫瘍患者におけるbevacizumab療法の予測価値は観察されませんでした。
専門家のコメント
この堅牢な分析は、第3相試験データと先進的な画像定量技術を活用し、TTVがRECIST1.1よりも優れたバイオマーカーであることを実証しています。TTVの体積的性質は、直径に基づくRECIST評価の制限を解決し、全体の腫瘍負荷と腫瘍質量の生物学的に関連性のある変化を捉えます。基準時負荷と体積変化を組み合わせることで、個別化管理決定に必要な細かい層別化が可能となります。
TTVが治療選択の指針となる可能性、特にRAS/BRAF野生型左側原発腫瘍患者におけるbevacizumabとpanitumumabの選択については特に興味深いですが、メカニズム的な探求が必要です。これらの知見は、再sectabilityの純粋な解剖学的評価から、生物学的に情報に基づく治療戦略への臨床的パラダイムのシフトにつながる可能性があります。重要なのは、手動セグメンテーションの要件が現在の普及を制限しており、自動化の努力が臨床的実現可能性を向上させるべきであることです。
研究の制限には、当初手術不能であった肝単独疾患に焦点を当てていることから、切除可能および多臓器転移の文脈での検証が必要であることが挙げられます。特定の試験アームの早期終了と限られた分子サブタイプの存在により、レジメン固有の予測効果に関する確定的な結論を導き出すことはできません。さらに、臨床的実装には、基準時腫瘍負荷の異質性を捉えるためのTTV減少の適切な閾値が必要であり、一様な閾値では不十分です。
結論
総腫瘍体積とその化学療法後の早期変化は、RECIST1.1よりも優れた予後予測値と予測値を提供し、当初手術不能の大腸がん肝転移患者において、生存予測の精度を向上させ、より敏感な反応モニタリングを可能にし、bevacizumabやpanitumumabなどの標的全身療法の選択を個別化する可能性があります。自動体積解析のさらなる検証と技術的向上が待たれる中、TTVは先進的大腸がんの多学科的管理を向上させる有望な画像バイオマーカーとなっています。
参考文献
1. Adam R et al. The oncosurgery approach to managing liver metastases from colorectal cancer: a multidisciplinary international consensus. Oncologist. 2012;17(10):1225–39.
2. de Ridder JAM et al. Management of liver metastases in colorectal cancer patients: a retrospective case-control study of systemic therapy versus liver resection. Eur J Cancer. 2016;59:13–21.
3. Angelsen JH et al. Population-based study on resection rates and survival in patients with colorectal liver metastasis in Norway. Br J Surg. 2017;104(5):580–9.
4. Van den Eynde M, Hendlisz A. Treatment of colorectal liver metastases: a review. Rev Recent Clin Trials. 2009;4(1):56–62.
5. Kopetz S et al. Improved survival in metastatic colorectal cancer is associated with adoption of hepatic resection and improved chemotherapy. J Clin Oncol. 2009;27(22):3677–83.
6. Poston GJ et al. Urgent need for a new staging system in advanced colorectal cancer. J Clin Oncol. 2008;26(29):4828–33.
7. Adam R et al. Rescue surgery for unresectable colorectal liver metastases downstaged by chemotherapy: a model to predict long-term survival. Ann Surg. 2004;240(4):644–57.
8. Adam R, Kitano Y. Multidisciplinary approach of liver metastases from colorectal cancer. Ann Gastroenterol Surg. 2019;3(1):50–6.
9. Lam VW et al. A systematic review of clinical response and survival outcomes of downsizing systemic chemotherapy and rescue liver surgery in patients with initially unresectable colorectal liver metastases. Ann Surg Oncol. 2012;19(4):1292–301.
10. Adam R. Developing strategies for liver metastases from colorectal cancer. Semin Oncol. 2007;34(2 1):S7–11.
11. Rothe JH et al. Size determination and response assessment of liver metastases with computed tomography–comparison of RECIST and volumetric algorithms. Eur J Radiol. 2013;82(11):1831–9.
12. Laubender RP et al. Evaluating the agreement between tumour volumetry and the estimated volumes of tumour lesions using an algorithm. Eur Radiol. 2014;24(7):1521–8.
13. Eisenhauer EA et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009;45(2):228–47.
14. Bereska JI et al. Development and external evaluation of a self-learning auto-segmentation model for colorectal cancer liver metastases assessment (COALA). Insights Imaging. 2024;15(1):279.
15. Michiel Zeeuw J et al. Prognostic value of total tumor volume in patients with colorectal liver metastases: a secondary analysis of the randomized CAIRO5 trial with external cohort validation. Eur J Cancer. 2024;207:114185.
16. Bond MJG et al. First-line systemic treatment strategies in patients with initially unresectable colorectal cancer liver metastases (CAIRO5): an open-label, multicentre, randomised, controlled, phase 3 study. Lancet Oncol. 2023;24(7):757–71.
[詳細な参考文献リストは主出版物で入手可能です。]



