ハイライト
– 特定の抗生物質(マクロライドおよびペニシリンを除く)の曝露は、ペムブロリズマブ治療を受けている進行非小細胞肺がん患者の全生存期間(OS)の短縮と相関しています。
– ステロイドの使用量が、単剤治療では20 mg以上のプレドニゾン相当量、化学療法との併用では30 mg以上の場合、生存率が低下します。
– プロトンポンプ阻害剤(PPI)は、この患者集団の全生存期間の悪化と独立して関連しています。
– これらの知見は、免疫療法の効果を最適化するために、併用薬の評価が必要であることを強調しています。
研究背景と疾患負担
非小細胞肺がん(NSCLC)は、最も一般的な肺がんのタイプであり、世界中でがん関連死亡の主な原因となっています。免疫チェックポイント阻害剤(例:ペムブロリズマブ、PD-1阻害剤)の登場により、進行NSCLCの一次治療が変革され、生存結果が改善しました。しかし、治療効果は患者間で大きく異なり、腫瘍の分子特性だけでなく、宿主要因(特に併用薬)によっても影響を受けます。
抗生物質、全身性ステロイド、プロトンポンプ阻害剤(PPI)は、様々な合併症やがん関連症状に対して頻繁に投与されます。最近の証拠では、これらの薬物が腸内微生物叢を変化させたり、免疫応答を調整したり、薬物代謝に影響を与えることにより、免疫チェックポイント阻害剤の効果を損なう可能性があると示されています。しかし、これらの薬物がペムブロリズマブ治療を受けている進行NSCLC患者の生存結果にどのように影響するかについて、大規模な人口レベルでのデータは限られています。
研究デザイン
この大規模な全国後向きコホート研究では、フランスの国民保健データベースを活用して、進行NSCLC患者における併用薬の全生存期間への影響を検討しました。2015年1月から2022年12月までに新規診断され、一次治療としてペムブロリズマブを開始し、治療開始後2ヶ月以内に生存していた患者が対象となりました。
除外基準には、感染症、自己免疫疾患、胃潰瘍で入院した患者が含まれており、研究対象となる併用薬の使用目的による混雑因子を避けるためです。
薬物曝露は以下のとおり定義されました:抗生物質とPPIの曝露は、ペムブロリズマブ開始日の60日前から42日後に少なくとも2回の処方が必要でした。ステロイドの曝露は、ペムブロリズマブ開始日の30日前から30日後に少なくとも2回の処方が必要でした。また、ステロイドの用量強度も、プレドニゾン相当量の毎日の用量に基づいて評価されました。
主要エンドポイントは全生存期間(OS)でした。逆確率重み付け(IPTW)解析アプローチを使用して、曝露群と非曝露群の結果比較における混雑バイアスを最小限に抑えました。
主要な知見
研究対象となった41,529人の進行NSCLC患者のうち、27,826人(67%)が男性で、中央年齢は65歳(範囲19-97歳)でした。そのうち35.7%が単剤ペムブロリズマブを、64.3%がペムブロリズマブと化学療法の併用療法を受けました。
治療開始時には、41.9%が抗生物質、59.1%がステロイド、53.7%がPPIに曝露されていました。
Figure 1. Weighted Distribution by Antibiotc, Steroid, or Proton Pump Inhibitor (PPI) Exposure.

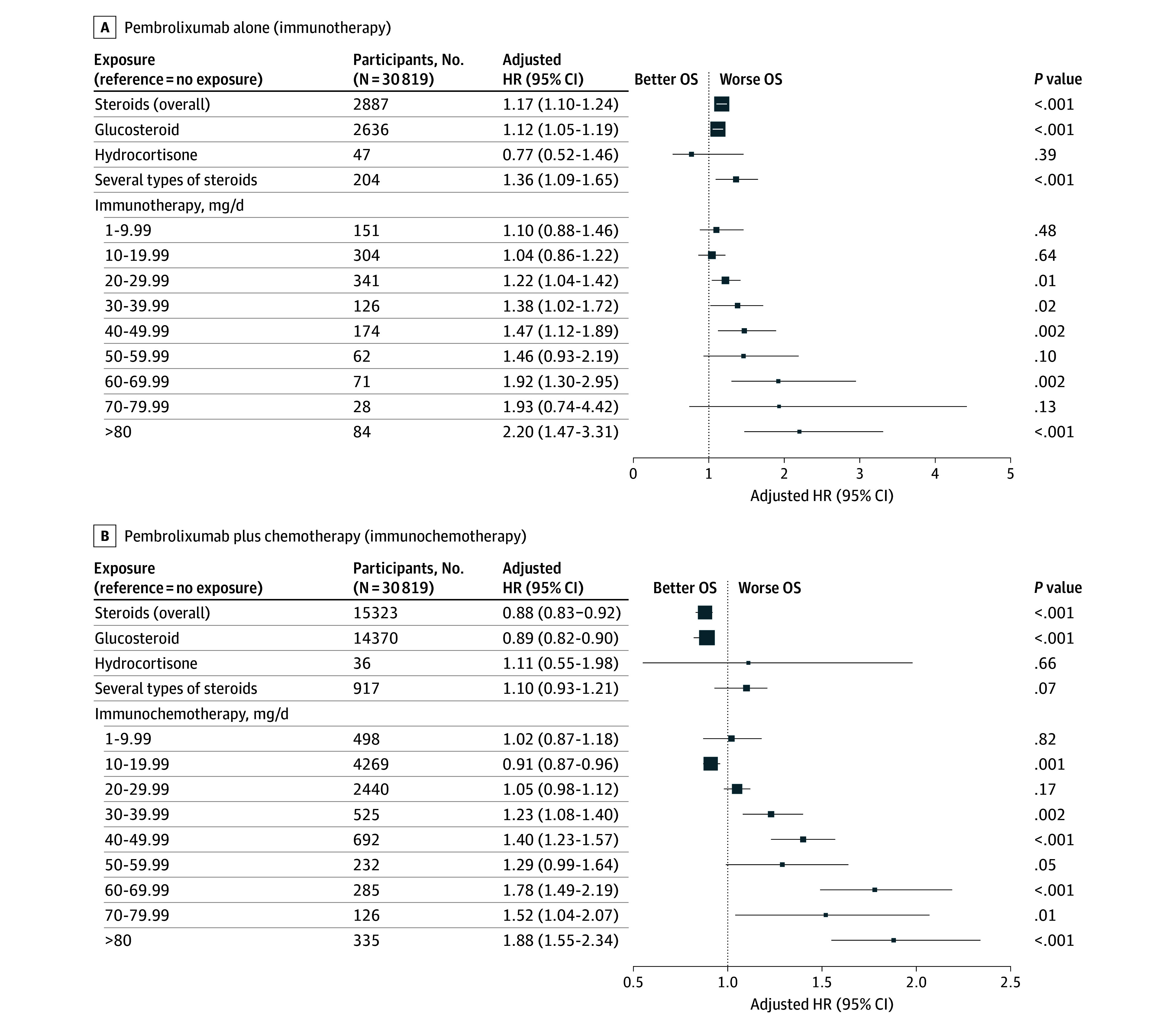
抗生物質: IPTW調整後、抗生物質の使用は全生存期間(OS)の微弱だが統計的に有意な短縮と関連していました(ハザード比[HR] 1.08、95%信頼区間[CI] 1.05-1.12、P < .001)。ただし、この関連性はすべての抗生物質クラスに一様ではなく、マクロライドとペニシリンは生存に悪影響を与えないことが示唆されました。これは、抗生物質の種類による異なる腸内微生物叢の乱れや免疫調整に起因する可能性があります。
Figure 2. Assocications of Overall Survival (OS) With Antibiotic Exposure Among Those Receiving Pembrolizumab Alone and Pembrolizumab Plus Chemotherapy.

ステロイド:全体的なステロイド曝露は、全生存期間(OS)との間に有意な関連は見られませんでした(HR 0.98、95% CI 0.95-1.02、P = .37)。しかし、ペムブロリズマブ療法(単剤療法と併用療法)との間で有意な相互作用が見つかりました(P < .001)。用量依存解析では、プレドニゾン相当量の用量が高くなるにつれて生存が悪化することが明らかになりました:単剤療法患者では20 mg/日以上、併用療法患者では30 mg/日以上が悪い結果と関連していました(単剤療法患者の傾向のP値 = .005、併用療法患者の傾向のP値 < .001)。これは、高用量ステロイドが抗腫瘍免疫に影響を与える免疫抑制効果を示しています。
Figure 3. Associations of Overall Survival (OS) With Steroid Exposure Among Those Receiving Pembrolizumab Alone and Pembrolizumab Plus Chemotherapy.
プロトンポンプ阻害剤(PPI): PPIの使用は、全生存期間(OS)の著しい悪化と関連していました(HR 1.13、95% CI 1.10-1.17、P < .001)。これは、PPIが腸内微生物叢を乱し、免疫チェックポイント阻害剤の効果を低下させる可能性があるという以前の報告と一致しています。
Figure 4. Proton Pump Inhibitor (PPI) Exposure and Overall Survival (OS).
専門家のコメント
この大規模な実世界分析は、以前の小さな研究で併用薬と免疫療法の結果との関連が示されたことを拡張し、クラスごとのおよび用量依存的な効果に関する詳細な洞察を提供しています。観察された抗生物質クラスの効果は、腸内微生物叢の乱れが免疫療法の効果に影響を与えるという仮説と一致しています。ステロイドの用量閾値の同定は、症状制御と免疫保存のバランスを取るための臨床的決定を洗練するのに役立ちます。
ただし、後向き観察研究であるため、高度なIPTW調整にもかかわらず、残留混雑因子が存在する可能性があります。指示による混雑因子は完全に排除できません——これらの薬物を必要とする患者は、予後が悪かったり、病態がより進行していたりする可能性があります。研究の特定の合併症の除外は、このリスクを緩和しますが、完全には排除しません。
メカニズム的には、抗生物質とPPIは、抗腫瘍T細胞応答のプライミングに不可欠な有益な共生腸内細菌を損なう可能性があります。高用量ステロイドは、チェックポイントブロック機構に重要なT細胞機能とサイトカイン産生を鈍化させます。将来の前向きおよびメカニズム的研究は、因果関係を完全に解明するために不可欠です。
結論
この包括的な全国コホート研究は、特定の抗生物質、高用量ステロイド、PPIが、進行非小細胞肺がん患者の一次治療としてペムブロリズマブと併用された場合、全生存期間の短縮と関連していることを示しています。これらの知見は、免疫療法中の併用薬の慎重な処方と密接なモニタリングの必要性を強調しています。
医師は、抗生物質とステロイドの適応、選択、用量を慎重に評価し、可能な限りPPIの使用を見直すべきです。これらの結果は、併用薬を通じた宿主と腸内微生物叢の調整が、免疫チェックポイント阻害剤の効果に著しく影響を与えるという証拠を追加しています。
今後の研究では、腸内微生物叢のプロファイリング、免疫型別化、前向き介入試験を統合して、否定的な併用薬効果を軽減し、個別化がん免疫療法を向上させるための戦略を開発する必要があります。
参考文献
Rousseau A, Simon-Tillaux N, Michiels S, et al. Concomitant Comedications and Survival With First-Line Pembrolizumab in Advanced Non-Small-Cell Lung Cancer. JAMA Netw Open. 2025;8(9):e2529225. doi:10.1001/jamanetworkopen.2025.29225 IF: 9.7 Q1 .
Derosa L, Routy B, Kroemer G, Zitvogel L. Microbiota and immunotherapy: diagnostic and therapeutic potential. Gastroenterology. 2021;160(7):2023-2041.
Arbour KC, Mezquita L, Long N, et al. Impact of baseline steroids on efficacy of programmed cell death-1 and programmed death-ligand 1 blockade in patients with non-small-cell lung cancer. J Clin Oncol. 2018;36(28):2872-2878.
Pinato DJ, Howlett S, Ottaviani D, et al. Association of prior antibiotic use with survival and response to immune checkpoint inhibitor therapy in patients with cancer. JAMA Oncol. 2019;5(12):1774-1778.