ハイライト
- 呼吸器ウイルス感染症(インフルエンザ、SARS-CoV-2)は、肺実質に潜む休眠中の転移性乳がん細胞(DCCs)を覚醒させ、その増殖と長期的な転移成長を促進することが、マウスモデルで確認されました。
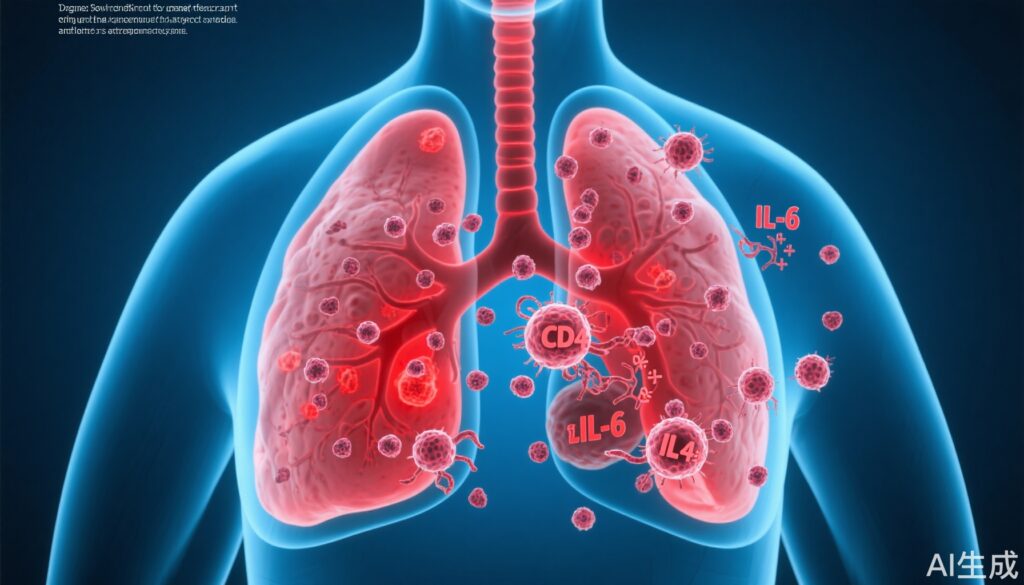
- サイトカインであるIL-6シグナル伝達経路は、初期の再活性化ステップに不可欠であり、CD4+ T細胞は抗腫瘍性のCD8+反応を抑制することで、その後の成長を維持します。
- 人間の登録データ分析(UKバイオバンクおよびFlatiron Healthのデータを含む)は、記録されたSARS-CoV-2感染を持つがん患者が、がん関連死亡率の増加と肺転移リスクの上昇を示すことを明らかにしました。
研究背景と疾患負担
乳がんは世界で最も一般的な悪性腫瘍の一つであり、明らかな寛解後も、転移性の乳がん細胞(DCCs)が肺、骨、肝臓などの遠隔臓器に数年から数十年間にわたって非増殖性の「休眠」状態で存在し続けることがあります。これらのDCCsが再活性化することは、晩期転移再発とがんによる死亡の主な原因となります。休眠を破る引き金となる要因を理解することは、再発予防の戦略を提供し得ます。
初期のCOVID-19パンデミック中には、SARS-CoV-2による直接的な死亡や診断・治療の遅延だけでは完全に説明できない、がん関連の超過死亡の兆候が観察されました。これは、肺感染症—局所炎症の一般的な原因—が、肺の微小環境を直接変化させ、休眠中のDCCsの覚醒を促進し、転移再発リスクを増加させるという仮説を引き起こしました。コロラド大学の研究チームが**『Nature』**誌に発表した論文(Respiratory viral infections awaken metastatic breast cancer cells in lungs, Nature, 2025)は、この仮説を前臨床モデルで直接検証し、人間の登録データ分析を加えて補完しました。
研究デザイン
このトランスレーショナル研究は、マウスを用いたメカニズム実験、in vitroアッセイ、および人間の臨床データベースの後ろ向き分析を組み合わせています。
- 前臨床モデル: 肺に休眠中のDCCsを形成することが知られている2つの独立した転移性乳がんマウスモデルが使用されました。ウイルスへの曝露前、腫瘍細胞は主に非増殖性(休眠)状態にありました。
- ウイルス曝露: 適切なマウスモデルにおいて、インフルエンザウイルスとSARS-CoV-2の実験的感染が行われました。
- 介入と操作: メカニズムを解明するために、腫瘍細胞におけるIL-6産生の遺伝子ノックアウト、in vitroでのIL-6処理、およびCD4+ T細胞の枯渇が行われました。免疫細胞の動態(CD4+およびCD8+ T細胞)とサイトカインシグナル伝達を評価するために、免疫表現型および遺伝子発現分析が使用されました。
- 人間データ分析: UKバイオバンク(複数のがん種を含む)とFlatiron Healthの電子カルテデータソース(乳がんコホート)のデータベースが照会され、記録されたSARS-CoV-2感染とその後のがん関連アウトカムとの関連性が評価されました。
- アウトカム: 感染したがん患者と感染していないがん患者のがん関連死亡率と新規肺転移の発生率が評価・比較され、利用可能な共変量が調整されました。
主要な発見
前臨床結果(マウスモデル):
- 呼吸器ウイルス感染後の迅速なDCCs再活性化: インフルエンザとSARS-CoV-2のマウスでのウイルス曝露実験において、以前に休眠していた肺のDCCsは、感染後15日以内に増殖の増加を示しました。この増殖は数ヶ月間持続し、最終的に明らかな転移病巣を形成しました。
- IL-6依存性: ウイルス感染後、DCCsと肺の微小環境はIL-6依存性シグナル伝達経路の活性化を示しました。IL-6産生が欠如するように遺伝子操作された腫瘍細胞は、ウイルス曝露後に増殖DCCsが明らかに少なかったのに対し、IL-6機能が正常な対照群ではそうではありませんでした。in vitro実験では、外因性IL-6が乳がん細胞の成長を増加させ、その直接的な増殖促進作用を裏付けています。
- IL-6と持続的な成長の時間的動態: 肺のIL-6タンパク質レベルは感染初期に著しく上昇しましたが、報告された実験では約15日以内に正常に戻りました。しかし、DCCsの増殖はより長く持続し、IL-6が再活性化を開始するものの、他のプロセスが転移成長を維持している可能性を示唆しています。
- 持続におけるCD4+ T細胞の役割: ウイルス感染後、CD4+ T細胞はDCCsを含む肺の領域に動員されました。実験的にCD4+ T細胞を枯渇させると、初期(9日目)の増殖DCCsの数には変化がありませんでしたが、後期(28日目)の増殖DCCsの数は減少しました。これは、CD4+ T細胞が再活性化された成長を維持するために必要であり、再活性化の引き金ではないことを示唆しています。
- CD4+細胞によるCD8+細胞の抑制: 遺伝子発現および免疫表現型は、CD4+ T細胞の枯渇が肺内のCD8+ T細胞の増加につながることを示しました。著者らは、感染中に動員されたCD4+ T細胞がCD8+を介した抗腫瘍免疫監視を制限し、その結果、DCCsの継続的な拡大を許容したと推論しています。
人間登録データ分析:
- 一貫した臨床的シグナル: UKバイオバンクとFlatironのデータを用いて、記録されたSARS-CoV-2感染を持つがん患者は、がん関連死亡率が有意に高く、肺転移リスクが増加することが報告されました。著者らは、これらの観察的関連は前臨床メカニズムと一致するものの、交絡因子が存在する可能性があるため、これ単独では因果関係を証明できないことを強調しています。
安全性および有害反応観察:
- この前臨床論文はメカニズムに焦点を当てており、古典的な薬剤や治療の安全性データは報告されていません。トランスレーショナルな観点から、この研究は潜在的な治療仮説(例えば、IL-6シグナル伝達経路を標的とする、またはCD4+/CD8+バランスを調節する)を提起していますが、これらの経路はウイルス防御と組織修復において中心的な役割を果たすため、これらの戦略は慎重に評価する必要があります。
専門家のコメントとメカニズムの妥当性
- 生物学的妥当性: これらの発見は、炎症とがんの進行との間の確立された関連性と一致しています。IL-6のようなサイトカインは急性炎症反応の中心的メディエーターであり、長い間、腫瘍細胞の増殖、生存、および腫瘍微小環境の調節に関与していると考えられてきました(Grivennikov et al., Cell 2010)。IL-6は、STAT3活性化を介して腫瘍細胞に直接作用し、増殖と生存を促進するだけでなく、免疫細胞の動員と間質のリモデリングを形成することで間接的に作用することもできます。
- 免疫調節: CD4+ T細胞がCD8+を介した制御を制限することでDCCsの持続的な成長をサポートするという観察は、炎症中のCD4+サブセット(ヘルパーと制御性)の複雑な役割と一致しています。CD4+制御性T細胞(Tregs)は細胞傷害性反応を抑制し、組織修復を促進することができます。ウイルス感染後の炎症環境では、この抑制が無意識のうちに再活性化された腫瘍細胞を排除から守る可能性があります。
- 臨床的意義: これらのデータが確認され、一般化されれば、呼吸器感染症は、特に肺に転移することが多いがん種にとって、転移再発の修正可能なリスク因子となる可能性があります。これは、がん生存者のケアと感染予防戦略について、実際的な疑問を投げかけます。
- 限界と代替的解釈: 前臨床の限界:マウスモデルは、人間の複雑ながん生物学、免疫プロファイル、事前の治療、併存疾患、または人間のウイルス曝露を完全に再現することはできません。実験で使用されるウイルスのタイミング、用量、および株は免疫応答に影響を与え、典型的な人間の感染とは一致しない可能性があります。
- 人間データの制約: 観察的な登録データ分析は、交絡因子(例:健康状態、社会経済的要因、がんの病期、治療の中断、ワクチン接種状況)の影響を受けます。逆因果関係(例:より脆弱な個人は重度のCOVID-19にかかりやすく、がんで死亡しやすい)の可能性も、調整が行われたにもかかわらず残ります。
- 治療の慎重さ: IL-6阻害剤(例:トシリズマブ)はCOVID-19で過剰な炎症を治療するために使用されました。しかし、転移リスクを減らすためにIL-6阻害剤を使用することは、IL-6が感染制御と組織修復に不可欠であるため、非常に複雑になるでしょう。同様に、広範なCD4+ T細胞の枯渇は免疫抑制的であり、安全ではありません。
- 先行文献との関連: 先行研究では、パンデミック中のがん死亡者の増加とスクリーニング/診断の減少が記録されています(例:Kaufman et al., JAMA Netw Open 2020; Maringe et al., Lancet Oncol 2020)。『Nature』の研究は、診断や治療の中断とは独立して、感染自体が生物学的にがんの予後を悪化させる可能性があるというメカニズム的な層の証拠を追加しました。
臨床的および研究的意義
臨床医向け:
- 予防に焦点を当てる: がん生存者、特に肺に転移することが知られているがん患者において、呼吸器感染症の予防を強化する(ガイドラインに従ったワクチン接種[インフルエンザ、COVID-19]、必要に応じた早期抗ウイルス治療、および標準的な感染制御策)こと。
- 呼吸器感染中および感染後の警戒を維持する: 重度の呼吸器感染症の後、適切な患者は、過剰検査のリスクとコストを考慮しつつ、転移再発の兆候や症状をより綿密に監視すべきです。
- 治療研究の慎重さ: 既存の免疫調節薬(IL-6阻害剤、免疫チェックポイント阻害剤)は潜在的なトランスレーショナルパスウェイを提供しますが、厳格な臨床試験なしに転移予防のために経験的に再利用すべきではありません。
研究者向け:
- 再現と拡張: 他の腫瘍タイプやモデル、特に事前の治療や免疫老化を捉えることができるモデルで、独立した再現と拡張を行うこと。
- メカニズムの解剖: 一時的なIL-6の上昇を超えて、持続的な成長を駆動する要因(間質のリモデリング、間質細胞の変化、持続的なT細胞の極性化)を特定すること。
- 介入試験: 感染制御と腫瘍学的な安全性のバランスを取りつつ、感染周囲の戦略(例:感染のタイミングに合わせたサイトカイン調節)をテストする、慎重に設計されたトランスレーショナル試験を行うこと。
結論
『Nature』論文は、一般的な呼吸器ウイルスが、IL-6を介した初期段階と、その後のCD4+ T細胞に依存したCD8+制御の抑制を通じて、肺内の休眠中の乳がんDCCsを覚醒させ、持続的な転移成長を引き起こすという、説得力のある前臨床証拠を提供しています。マウス研究と合わせて提示された観察的な人間データは、SARS-CoV-2感染後のがん関連死亡率と肺転移リスクの増加を示しています。人間における因果関係はまだ完全に確立されていませんが、この研究は、感染、炎症、転移再発を結びつける潜在的に修正可能な経路を特定し、がん生存者のケアにおける感染予防と、メカニズムを標的とした研究の重要性を強調しています。
参考文献
1. University of Colorado authors. Respiratory viral infections awaken metastatic breast cancer cells in lungs. Nature. 2025. https://www.nature.com/articles/s41586-025-09332-0
2. Kaufman HW, Chen Z, Niles J, Fesko Y. Changes in the Number of US Patients With Newly Identified Cancer Before and During the Coronavirus Disease 2019 (COVID‑19) Pandemic. JAMA Netw Open. 2020;3(8):e2017267. doi:10.1001/jamanetworkopen.2020.17267 IF: 9.7 Q1 3. Maringe C, Spicer J, Morris M, et al. The impact of the COVID‑19 pandemic on cancer deaths due to delays in diagnosis in England, UK: a national, population‑based, modelling study. Lancet Oncol. 2020;21(8):1023‑1034. doi:10.1016/S1470-2045(20)30388-0 IF: 35.9 Q1 4. Grivennikov SI, Greten FR, Karin M. Immunity, Inflammation, and Cancer. Cell. 2010;140(6):883‑899. doi:10.1016/j.cell.2010.01.025 IF: 42.5 Q1 5. Schreiber RD, Old LJ, Smyth MJ. Cancer immunoediting: integrating immunity’s roles in cancer suppression and promotion. Science. 2011;331(6024):1565‑1570. doi:10.1126/science.1203486 IF: 45.8 Q1