ハイライト
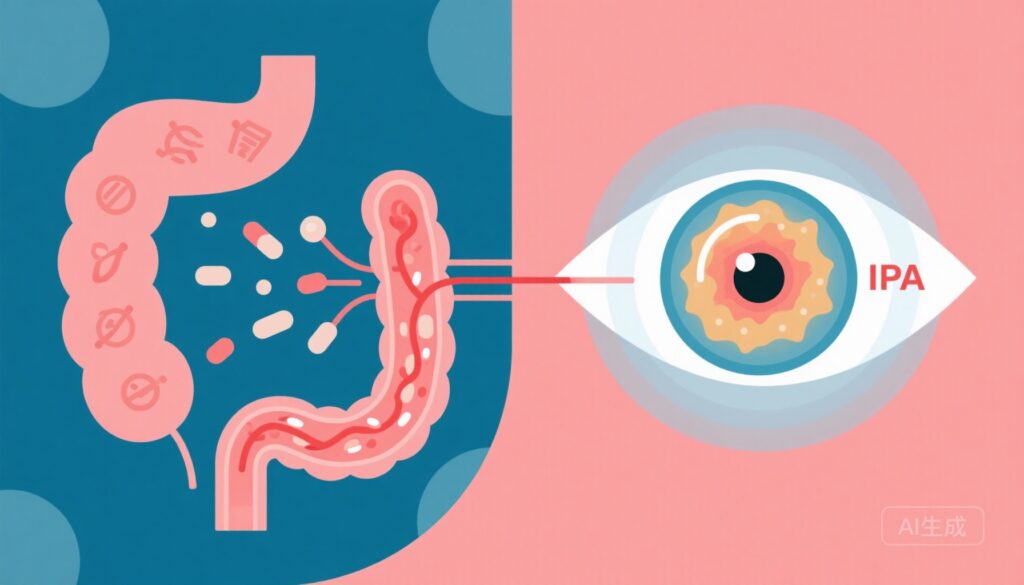
– 翻訳研究(Prasadら、Gut 2025)では、腸由来のインドール-3-プロピオン酸(IPA)が実験的な2型糖尿病における網膜保護と関連しており、糖尿病性網膜症(DR)患者での低循環IPAを示しました。
– 腸内トリプトファン(Trp)吸収を回復する2つの戦略—ACE2を保存するLactobacillus paracaseiを使用した方法と、ACE2非依存性のTrpジペプチド(イソロイシン-トリプトファン、IW)—は、db/dbマウスでのDRを予防し、代謝制御と腸バリアの完全性を改善し、Trp代謝菌を豊富にしました。
– 2型糖尿病(T2D)患者では、DRがエンドトキシミアの生化学的証拠と腸バリアマーカーの低下、低血清IPAと高インドキシル硫酸塩と関連していたことから、病原性の腸-網膜軸と潜在的なバイオマーカーおよび治療標的が示唆されました。
背景:疾患負担と理由
糖尿病性網膜症(DR)は、世界中の労働年齢の成人の視力喪失の主な原因であり続けています。国際糖尿病連合(IDF)は、数百万人が糖尿病を患っており、その合併症も増加していると推定しています。現在の予防策—血糖、血圧、脂質の管理とスクリーニング、適時の眼科治療—は視力喪失を減らしましたが、完全には排除していません。特に、疾患発症の上流で介入する新しい予防策と早期介入アプローチが必要です。
新興の証拠は、腸内細菌叢の変化、腸バリア機能障害、代謝物信号伝達が代謝疾患に関与することを示しています。トリプトファン(Trp)は、ホスト経路(キヌレニン)と微生物経路によりインドールやその他の小分子に代謝されます。一部のインドール誘導体は粘膜の完全性と全身の恒常性に有益な影響を及ぼす一方で、インドキシル硫酸塩などの他の化合物は毒性と関連しています。特定のトリプトファン由来の微生物代謝物がDRに影響を与えるかどうかを理解することは、バイオマーカーと新たな治療戦略を明らかにする可能性があります。
研究設計と方法
Prasadらは、Trp吸収を回復またはTrp由来代謝物を提供することでDRに影響を与えるかどうかを検証するために、並行して前臨床および人間観察研究を行いました。
前臨床(db/dbマウスモデル)
– モデル:メタボリック機能不全と網膜微小血管疾患を起こりやすい2型糖尿病モデルであるレプチン受容体欠損db/dbマウス。
– 干渉:Trpの生物利用能を向上させる2つの経口戦略—(1)腸内ACE2と中性アミノ酸ナトリウム共輸送体を保存するように遺伝子組換えされたLactobacillus paracaseiを用いた投与、これによりACE2依存性のTrp吸収が向上します;(2)ペプチドトランスポーターSLC15A1(PEPT1)を介して吸収されるACE2非依存性のTrpジペプチド(イソロイシン-トリプトファン、IW)の投与。
– 治療期間:両戦略とも、早期からの6か月間の治療としての予防と、後期からの3か月間の治療としての介入としてテストされました。
– 評価項目:腸組織学とバリア機能、腸内細菌叢構成、代謝指標(血糖調節、インクレチン分泌)、網膜構造と機能評価(空間質量分析による網膜層内の代謝物マッピングを含む)。
ヒトコホート
– 成人のプラズマバイオマーカーの横断的比較:DRのある2型糖尿病患者(n=30)、DRのない2型糖尿病患者(n=40)、健康対照群(n=35)。
– 測定:プラズマTrp代謝物(IPAとインドキシル硫酸塩を含む)と腸透過性およびエンドトキシミアの血清学的マーカー。
主要な結果
前臨床結果 — db/dbマウスにおけるDRの予防と逆転
– 網膜損傷の予防:Lactobacillus paracasei-ACE2とIWジペプチド治療は、長期の予防療法として使用された場合、db/dbマウスにおける糖尿病性網膜変化の発症を予防し、短期の介入として後に与えられた場合にも有益な効果を示しました。
– 腸生理機能の回復:治療は、糖尿病関連の異常菌叢を修正し、Trp代謝菌を選択的に豊富にし、腸バリアの完全性を改善しました。腸透過性とエンドトキシミアのマーカーが減少しました。
– 代謝効果:治療マウスは、血糖調節が改善され、インクレチン分泌が増加し、腸内アミノ酸処理の回復が全身の代謝効果と結びついていることを示しました。
– 網膜代謝物の局在化:空間質量分析により、インドール-3-プロピオン酸(IPA)が網膜色素上皮(RPE)層と後部血網膜バリア内で局在化することが示され、バリアの完全性が重要な場所での局所蓄積が示唆されました。
– 機序的意義:IPAは、RPEレベルでのバリア保護を媒介する候補の効果分子として同定されました。本研究では単一のレセプター依存性経路は定義されていませんが、IPAの既知の抗酸化作用とバリア支援作用は、腸由来代謝物が網膜保護に寄与する生物学的に合理的な機序を提供しています。
ヒト観察結果
– DRにおける循環代謝物の変化:2型糖尿病(T2D)かつDRのある人々は、T2DかつDRのない人々や健康対照群と比較して、低循環IPAレベルと、他の臓器系での毒性と関連するインドキシル硫酸塩の高レベルを示しました。
– 腸漏れとエンドトキシミアの証拠:DRのある個体は、DRのない個体と比較して、腸バリアの破壊とエンドトキシミアを示す血清マーカーが高値を示し、マウスで観察された腸-網膜接続の翻訳的関連性を支持しました。
安全性とその他の観察
– この前臨床-ヒト翻訳研究の要約では具体的な副作用プロファイルは報告されていませんが、遺伝子組換えプロバイオティクスの投与と慢性ペプチド投与は、臨床使用前に厳密な評価を必要とする予測可能な安全性と規制上の考慮事項を伴います。
専門家のコメントと解釈
この研究は、腸由来の微生物代謝物(IPA)が、糖尿病における網膜バリアを保護するバイオマーカーおよびメディエーターであるという説得力のあるパラダイムを進めています。いくつかのポイントを強調します:
– 生物学的合理性:IPAは特定の腸内細菌によって飲食中のTrpから生成されます。IPAには抗酸化作用があり、他の組織でのバリア完全性の維持と関連しています。空間MSの結果、IPAがRPEに集中していることが示され、保護的作用の一貫した組織レベルの証拠が得られました。
– 2つの補完的な戦略:研究では、Trp処理の回復は、ホスト-微生物インターフェースの操作(ACE2を保存するプロバイオティクス)またはホスト依存性輸送の回避(ペプチドIW)のいずれかによって達成できることを示しました。両方のアプローチが有益な結果に収束したことから、因果関係の推論が強まりました。
– ヒトでの臨床的シグナル:ヒトのバイオマーカーデータ—DRにおける低IPAと高インドキシル硫酸塩—は前臨床の結果と一致し、IPAがリスク分類や治療モニタリングの候補の循環バイオマーカーであることを支持します。
– 制限と一般化可能性:前臨床の証拠は強いですが、単一の動物モデルに留まっています。Db/dbマウスは2型糖尿病の多くの代謝特徴を再現しますが、人間のDRのすべての側面をモデル化することはできません。ヒトデータは横断的であり、因果関係を証明することはできません。薬剤(例:抗生物質、メトフォルミン)、食事、腎機能、その他の合併症による混雑が循環代謝物に影響を及ぼす可能性があるため、注意が必要です。臨床コホートのサンプルサイズは控えめであり、混雑要因を慎重に制御した大規模な前向きコホートでの再現が必要です。
– 安全性と翻訳パス:ホストACE2を調節する遺伝子組換えプロバイオティクスや長期のペプチド補給は、堅牢な安全性評価、管理戦略、規制審査を必要とします。あるいは、純粋なIPAの直接補給(栄養補助食品または薬剤として)は魅力的でより制御可能な戦略ですが、用量、薬物動態、毒性試験を必要とします。
臨床的および研究的意義
– バイオマーカー開発:循環IPAは、DRのリスクが高い2型糖尿病患者を特定したり、腸を標的とした介入の反応をモニタリングするための非侵襲的なバイオマーカーの可能性があります。前向き検証が必要です。
– 治療戦略:いくつかの翻訳パスが現れます:(1)有益なTrp代謝を回復するための微生物指向療法(プロバイオティクス、プレバイオティクス、便内細菌群指向アプローチ)、(2)Trpの生物利用能を増加させるためのペプチドまたは栄養補助食品アプローチ(例:IW)、(3)直接的なIPA補給。各パスには安全性和効果性試験が必要です。
– 試験デザインの考慮点:早期DRまたは高リスク2型糖尿病集団における無作為化プラセボ対照試験では、網膜構造と機能の評価(OCT、眼底写真、視覚機能)、全身の代謝結果、腸透過性マーカー、包括的な代謝組成を測定して、因果関係と最適な用量を確立する必要があります。
結論
Prasadらは、Trp代謝の乱れと、微生物由来の代謝物インドール-3-プロピオン酸の減少が糖尿病性網膜症と関連しているという前臨床とヒトの収束的証拠を提供しました。ACE2を保存するプロバイオティクスまたはACE2非依存性のTrpジペプチドを使用してTrp処理を回復させたことで、マウスモデルでのDRが予防され、全身の代謝と腸バリア機能が改善し、網膜色素上皮にIPAが豊富になりました。DR患者における低IPAと高インドキシル硫酸塩を示す横断的ヒトデータは、翻訳的関連性を支持しています。これらの結果は、IPAを有望なバイオマーカーと位置づけ、さらに開発すべきいくつかの腸を標的とした治療戦略を提示していますが、臨床的翻訳には前向きなヒト試験、厳密な安全性評価、機序の明確化が必要です。
資金源とclinicaltrials.gov
資金源と試験登録の詳細は、原著論文に報告されています:Prasad R et al., Gut. 2025 Nov 5. 読者は、具体的な助成金と機関の支援情報については、公開された論文を参照してください。IPA補給によるDRの試験を登録した人間介入試験はこの要約には報告されていません。将来の臨床開発では、計画された試験をClinicalTrials.govに登録する必要があります。
参考文献
1. Prasad R, Adu-Rutledge Y, Ziani B, et al. Indole-3-propionic acid links gut dysfunction to diabetic retinopathy: a biomarker and novel therapeutic approach. Gut. 2025 Nov 5:gutjnl-2025-336180. doi:10.1136/gutjnl-2025-336180. PMID: 41198173.
2. Cheung N, Mitchell P, Wong TY. Diabetic retinopathy. Lancet. 2010 Jul 10;376(9735):124-36. doi:10.1016/S0140-6736(09)62124-3.
3. International Diabetes Federation. IDF Diabetes Atlas, 10th ed. 2021. (疫学と負担の見積もりのためのアクセス。)
4. Dodd D, et al. A gut bacterial pathway metabolizes aromatic amino acids into circulating metabolites. Cell Host Microbe. 2017;21(3):1-??. (インドールを含むIPAを生成する微生物の芳香族アミノ酸代謝を説明。)
著者注
この記事は、最近の翻訳研究の結果をまとめ、それを医師、研究者、保健政策関係者のための臨床的文脈に置き直しています。実験方法、原始データ、補足分析の詳細については、原著Gut論文と付属資料を参照してください。