ハイライト
- 化学放射線療法後にペムブロリズマブを投与する逐次療法は、局所進行頭頸部癌において、同時療法と比較して4年局所制御率 (LRC) が有意に改善した。
- 両治療戦略は効果性と安全性の基準を満たしたが、逐次療法は無増悪生存率と全生存率で数値的に優れていた。
- ペムブロリズマブの投与タイミングによって腫瘍微小環境での異なる免疫抑制変化が観察され、今後の免疫療法戦略に示唆を与えた。
- この無作為化第II相試験は、高リスクHNSCCにおける標準化学放射線療法との最適な免疫療法統合に関する重要な問いに答えた。
研究背景と疾患負担
頭頸部扁平上皮癌 (HNSCC) は、特に局所進行期では著しい致死率と障害をもたらす侵襲的な悪性腫瘍群である。標準的な化学放射線療法 (CRT) とシスプラチンの併用にもかかわらず、予後は不十分であり、局所再発や遠隔転移のリスクが依然として高い。免疫チェックポイント阻害薬(例:ペムブロリズマブ)の登場により、再発/転移性症例の治療風景は大きく変わったが、新規診断の局所進行疾患に対するCRTとの組み合わせにおけるペムブロリズマブの最適な投与タイミングは不明である。この問いは、免疫療法の統合が腫瘍制御を向上させる可能性がある一方で、重複毒性や放射線や化学療法との潜在的な免疫抑制相互作用のリスクもあるため、臨床的に極めて重要である。
研究デザイン
これは、無作為化オープンラベル第II相試験 (NCT02777385) であり、新たに診断された局所進行HNSCC (主にIV期、T4および/またはN2疾患) の80例を対象とした。対象者はHPV陽性(追加のリスク因子あり)とHPV陰性の腫瘍を含む。患者はHPVとNステージによって層別化され、1:1で以下の2群に無作為に割り付けられた。
- 同時群: CRT (シスプラチン 40 mg/m2 週1回 + 放射線 70 Gy) の1週間前にペムブロリズマブ 200 mg 3週間毎に8サイクル投与開始。
- 逐次群: CRT完了後2週間後にペムブロリズマブ 200 mg 3週間毎に8サイクル投与開始。
主要複合エンドポイントは、各群が以下の3つの基準すべてを満たすことを必要とした:1年局所再発率 (LRF) <60%、1年無増悪生存率 (PFS) ≥60%、用量制限毒性 ≤20%。両群がこれらの基準を満たした場合、1年PFSが高い群が優れているとされる(勝者選択設計)。副次エンドポイントには4年局所制御率 (LRC)、PFS、全生存率 (OS)、腫瘍微小環境 (TME) 変化の翻訳解析が含まれる。
主要な知見
患者集団: 治療を受けた80例 (同時群 41例、逐次群 39例) のうち、92.5%がIV期疾患で、大塊性および/またはリンパ節陽性腫瘍の頻度が高かった。
効果性アウトカム:
- 両群とも事前に設定された主要効果性と安全性の基準を達成した:1年LRF (同時群 26%、逐次群 13%)、1年PFS (同時群 60%、逐次群 74%)、用量制限毒性 (両群 ≤20%)。
- 4年局所制御率 (LRC): 逐次群は有意に優れたLRCを示した (96% 対 64%; HR 0.11, 95% CI 0.01–0.89, P=0.012)。
- 4年無増悪生存率 (PFS): 逐次群は数値的に高いPFSを示した (69% 対 49%; HR 0.55, 95% CI 0.25–1.22, P=0.132) が、統計的有意差はなかった。
- 4年全生存率 (OS): 逐次群は数値的に優れたOSを示した (83% 対 71%; HR 0.51, 95% CI 0.19–1.37, P=0.17)。
- 最適なシスプラチン用量 (≥200 mg/m2) を受けた患者では、逐次群が4年LRCで依然として優れていた (96% 対 73%; HR 0.17, 95% CI 0.02–1.43, P=0.063)。
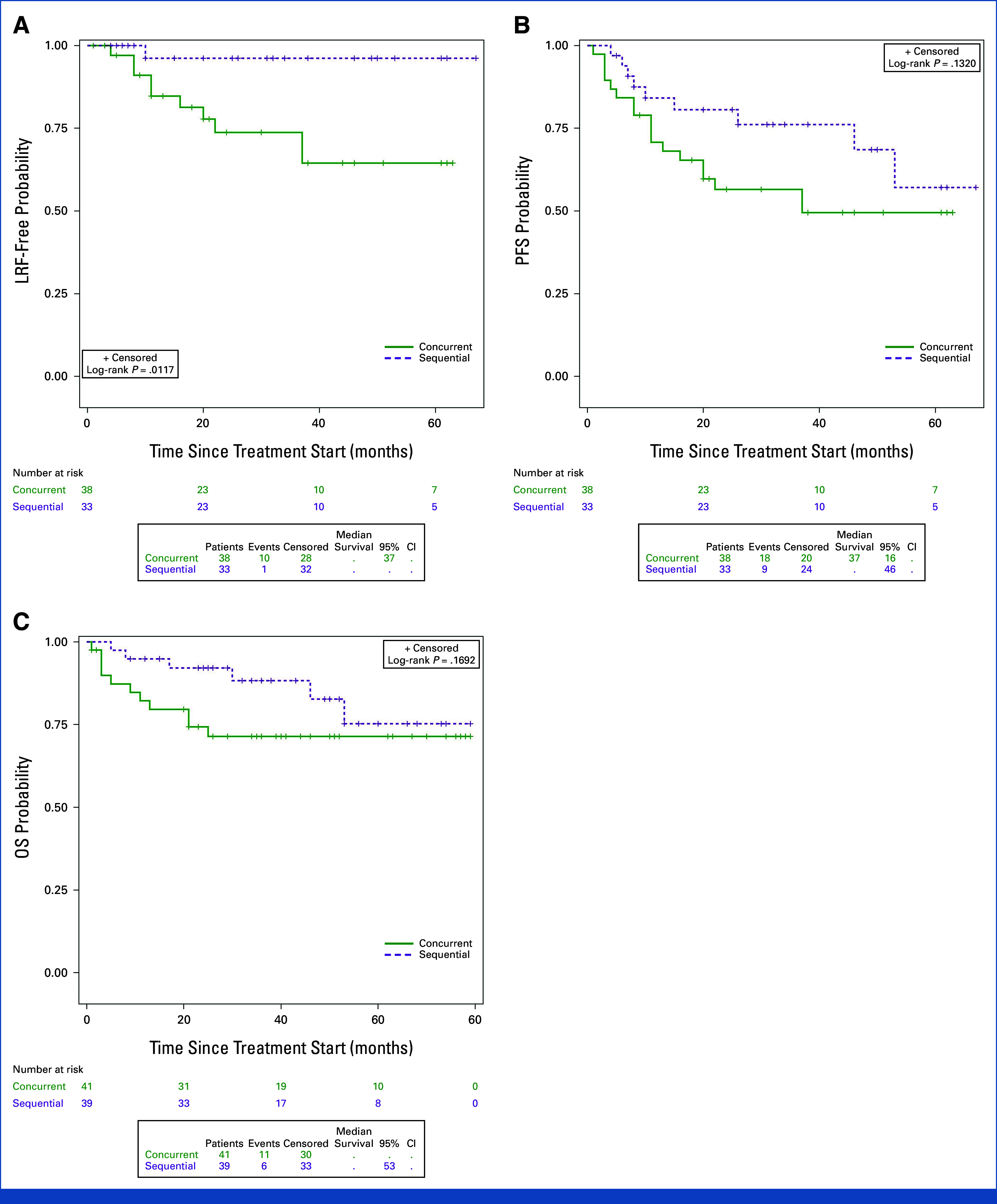
Evaluation of outcomes by treatment arm.
失敗パターン: 逐次群での進行の多くは遠隔部位であった (6例中5例)、一方、同時群では局所再発が多く見られた (12例中8例)。
安全性: 両戦略は管理可能な毒性プロファイルを示し、予想外の安全性信号や従属性の顕著な違いはなかった。
翻訳的洞察: 腫瘍生検では、同時群ではCRT前の初期ペムブロリズマブ曝露によって早期に免疫抑制変化が起こることが示された。具体的には、マクロファージ、PD-L1+マクロファージ、PD-L1+腫瘍細胞の有意な増加が観察されたが、逐次群では同様の変化は見られなかった。これは、初期のペムブロリズマブ曝露がTMEの免疫抑制変化を引き起こす可能性があることを示唆している。
専門家のコメント
この試験は、高リスクHNSCCにおける免疫チェックポイント阻害薬の投与タイミングが長期局所制御に大幅に影響を与える最初の無作為化証拠を提供した。同時群での初期高い反応率にもかかわらず、局所制御率が劣っていたことは、初期のペムブロリズマブ曝露による免疫抑制的なTME変化が潜在的な利益を打ち消す可能性があることを示唆している。対照的に、CRT後に免疫療法を延期することで、抗腫瘍免疫の回復が可能となり、放射線と化学療法の免疫原的効果を利用できる。重要的是、这两种方法都是可行且安全的,但只有逐次群实现了强大且持久的控制。
这些发现挑战了简单地将免疫疗法添加到标准CRT方案中的现行趋势,并强调了优化这些模式的时间整合机制和临床研究的必要性。局限性包括相对较小的样本量和需要在更大规模的III期试验中进行验证。两组之间TME生物学的差异为未来的相关研究和生物标志物开发提供了宝贵的基石。
结论
对于局部进展期HNSCC患者,化学放射线疗法后逐次给予佩姆布罗利珠单抗在长期局部控制方面显著优于同时给予,无进展生存率和总生存率也有有利的趋势。该试验突显了治疗顺序的关键重要性,并为进一步调查术后免疫疗法策略提供了依据。这些结果可能为未来指南和个人化治疗方案的制定提供参考。
参考文献
1. Zandberg DP, Vujanovic L, Clump DA, et al. Randomized Phase II Study of Concurrent Versus Sequential Pembrolizumab in Combination With Chemoradiation in Locally Advanced Head and Neck Cancer. J Clin Oncol. 2025 Aug 10;43(23):2572-2582. doi: 10.1200/JCO-24-01580 IF: 41.9 Q1 . Epub 2025 May 27. PMID: 40424564 IF: 41.9 Q1 ; PMCID: PMC12316147 IF: 41.9 Q1 .2. ClinicalTrials.gov Identifier: NCT02777385.