ハイライト
- LBMに基づくオキサリプラチン投与量は、標準投与量と比較してグレード≥2の末梢神経障害を軽減しました。
- LBM調整投与量を使用しても再発無生存期間や全生存期間に悪影響はありませんでした。
- 生活の質が向上し、LBMベースの群では投与量の減少が必要な頻度が低くなりました。
研究背景と疾患負担
大腸がんは世界中でがん関連死亡の主な原因の一つです。ステージIII大腸がん患者に対する補助化学療法として、オキサリプラチンを含む治療法(一般的にはFOLFOX:フルオロウラシル、リーコボリン、オキサリプラチン)が標準的であり、生存率の大幅な改善に貢献しています。しかし、オキサリプラチン誘発性末梢神経障害(OIPN)は、感覚障害、疼痛、機能障害を引き起こす主要な投与制限要因であり、しばしば障害となる副作用です。蓄積的な神経障害は、治療の中止、化学療法強度の低下、長期的な生活の質の低下につながります。従来、オキサリプラチンの投与量は体表面積(BSA)に基づいて決定されてきましたが、この方法は個人差、特に筋肉量(LBM)による薬物動態と毒性リスクへの影響を考慮していません。以前の分析では、3.09 mg/kg LBMを超える投与量が神経障害の増加と関連していることが示唆され、個別化投与がこのリスクを軽減できるかどうかの疑問が提起されました。
研究デザイン
LEANOX試験(NCT03255434)は、切除されたステージIII大腸がんの補助療法において、LBMに基づくオキサリプラチン投与量が神経障害を軽減するかどうかを検討することを目的とした多施設、第II相、ランダム化された概念実証試験でした。FOLFOX補助療法が適応される患者は、LBM状態に基づいて層別化されました:
– 臂1:LBM減少がない患者は、標準的なBSAベースのオキサリプラチン投与量(85 mg/m²)を受けました。
– 臂2と臂3:LBM減少がある患者は、1:1でBSAベースの投与量(臂2)またはLBMベースの投与量(3.09 mg/kg LBM、臂3)に無作為に割り付けられました。
主要評価項目は、最初の6つの化学療法サイクル中にグレード≥2のOIPNを発症していない患者の割合でした。二次評価項目には、グレード≥2のOIPN発症までの時間、神経障害なしで投与された累積オキサリプラチン投与量、投与量の減少、再発無生存期間(RFS)、全生存期間(OS)、患者報告型生活の質(QLQ-CIPN20スコアを使用)が含まれました。
合計160人の患者が登録され(臂1:33人、臂2:64人、臂3:63人)、中央年齢は63歳で、各臂間で人口統計学的および臨床的特性がバランスが取られていました。中央追跡期間は38.6ヶ月でした。
主要な知見
主要評価項目であるグレード≥2のOIPNのない患者の割合は、LBM調整群(臂3)で67.2%、BSAベースのLBM減少群(臂2)で42.1%と有意に違いがありました(P = .01)。重要なことに、LBM減少がない患者(臂1)ではこの効果は見られず、個別化投与が感受性のあるサブグループにとって価値があることを示唆しています。
その他の有効性と安全性の知見には以下の通りです:
– OIPNのない生存期間の延長:臂3では、グレード≥2のOIPN発症までの時間が有意に延長していました(ハザード比 [HR] 0.53;95% CI, 0.34–0.84;P = .01)。
– 神経障害の遅延:グレード≥2のOIPNの初回発症までの時間が臂3で有意に遅延していました(P = .006)。
– 投与量強度の向上:LBMベースの群では、有意な神経障害なしでより高い累積オキサリプラチン投与量が投与されており(P = .044)、投与強度が安全に維持できることを示唆しています。
– 投与量の減少/中断の頻度が低い:臂3では、オキサリプラチン投与量の減少の頻度が有意に低かったです(P < .001)。
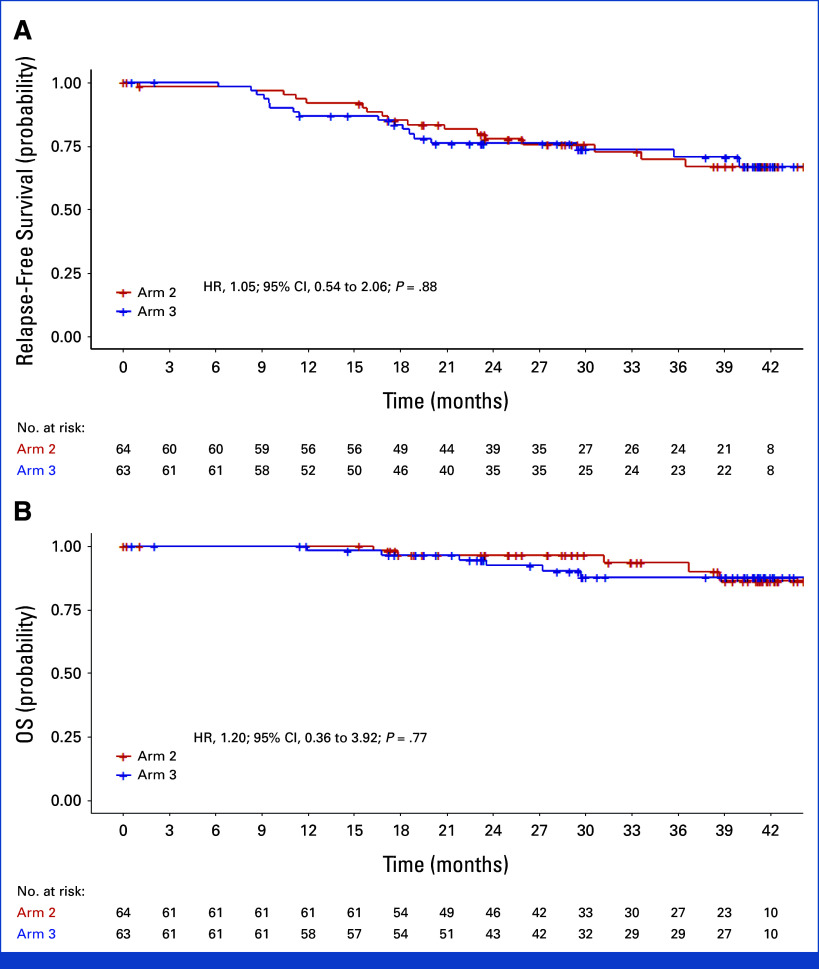
– 再発無生存期間と全生存期間:臂2と臂3の間でRFS(HR, 1.05 [95% CI, 0.54–2.06])やOS(HR, 1.20 [95% CI, 0.36–3.92])に統計的に有意な違いは見られませんでした。これらのデータは、LBMベースの投与量削減の腫瘍学的安全性を支持しています。
– 生活の質:患者報告型神経障害症状(QLQ-CIPN20スコア)は、LBMベースの群で有意に良好で、日常生活と健康状態の有意な改善を示しています。
Kaplan-Meir estimates of relapse-free survival and OS.
専門家のコメント
LEANOX試験は、LBMに基づくオキサリプラチン投与量が、ステージIII大腸がん患者の一部で化学療法誘発性神経障害の負担を軽減する合理的で安全かつ効果的な戦略であることを強く示唆しています。このアプローチは、補助療法の治癒ポテンシャルを損なうことなく、生活の質と機能状態を保つという重要な未充足のニーズに対処します。試験の強みには、堅固なランダム化設計、明確な患者層別化、臨床的に意味のある評価項目が含まれています。特に、生存率に悪影響がないことは、投与量削減が効果を低下させる懸念を和らげます。
ただし、いくつかの制限点も考慮する必要があります。試験は第II相であり、概念実証に焦点を当てており、ガイドラインへの統合を支持するためには、より大きな第III相試験が必要です。正確なLBMの測定(通常はCTやDEXAスキャンにより)が日常的な腫瘍学実践でのロジスティック上の課題となる可能性があります。さらに、多様な集団や他の化学療法レジメンへの一般化可能性はまだ確立されていません。
メカニズム的には、これらの知見は生物学的に説明可能です。LBMは薬物分布と排泄の主要な決定因子であり、BSAベースの投与量に曝露された筋肉量の少ない患者は、毒性に対する過剰なリスクにさらされる可能性があります。体組成に基づいた細胞障害性化学療法の個別化は、精密腫瘍学への有望な一歩です。
結論
第II相LEANOX試験は、LBMに基づくオキサリプラチン投与量が、ステージIII大腸がんの補助療法において神経障害を有意に軽減し、生活の質を改善し、再発無生存期間や全生存期間に悪影響を与えないことを示しています。これらの結果は、補助化学療法の耐容性と効果性を最適化するためのLBMベースの投与量調整戦略のさらなる研究と考慮を支持しています。広範な採用には、臨床実践におけるLBM測定の簡素化とアクセスの容易さを実現する方法の開発が必要となるでしょう。
参考文献
1. Assenat E, Ben Abdelghani M, Gourgou S, Perrier H, Akouz FK, Desgrippes R, Galais MP, Janiszewski C, Mazard T, Rinaldi Y, Lepage C, Tetreau R, Senesse P. Lean Body Mass-Based Oxaliplatin Dose Calculation on Neurotoxicity in Adjuvant Treatment of Stage III Colon Cancer: Results of the Phase II Randomized LEANOX Trial. J Clin Oncol. 2025 Aug 10;43(23):2616-2627. doi: 10.1200/JCO-24-02754 IF: 41.9 Q1 2. André T, et al. Oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment for colon cancer. N Engl J Med. 2004;350:2343-2351.
3. Grothey A, Sobrero AF, et al. Duration of adjuvant chemotherapy for stage III colon cancer. N Engl J Med. 2018;378:1177-1188.