はじめに
センソリニューラル聴覚障害(SNHL)は世界中で15億人以上の人々に影響を与え、障害の主要な原因となっています。その多因子性の病因には、遺伝子変異、騒音暴露、耳毒性薬物、加齢、ウイルス感染などが含まれます。最近の証拠では、NOD-likeレセプターpyrinドメイン含有3(NLRP3)インフラマソームが、炎症による蝸牛損傷の主要な駆動力であることが示されています。この先天性免疫複合体の異常活性化は、プロ炎症性サイトカイン放出とピロプトーシス細胞死の連鎖を引き起こし、進行性かつしばしば不可逆的な聴覚機能障害に寄与します。本稿では、NLRP3インフラマソームの機序的な役割を多様な聴覚障害の病因と関連付けながら、この経路を標的とする新規治療候補について検討します。
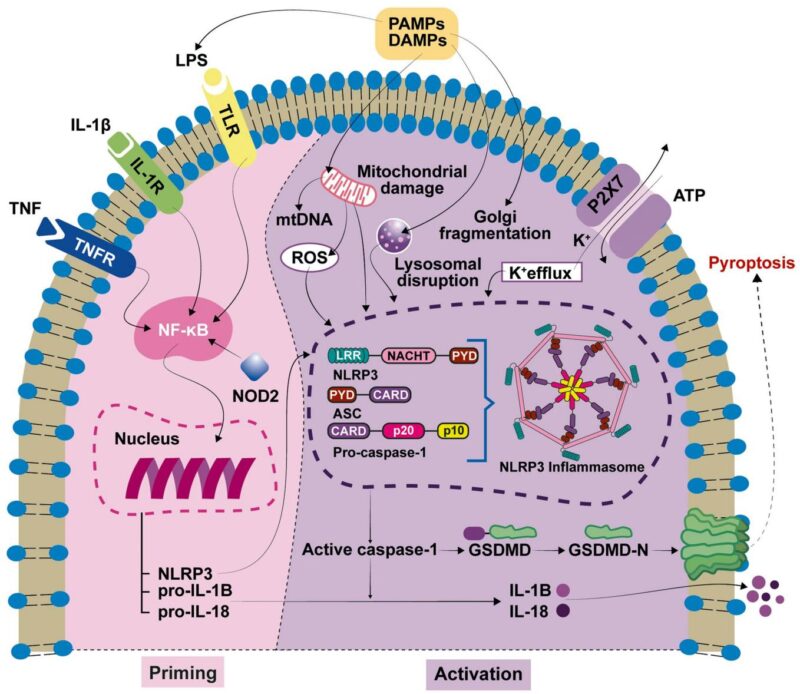
蝸牛でのNLRP3インフラマソームの生物学と活性化
NLRP3インフラマソームは、NLRP3センサータンパク質、アダプターASC、前駆体カスパーゼ-1からなる細胞質多タンパク複合体で、病原体や無菌性危険信号の細胞内センチネルとして機能します。活性化は2段階のプロセスを伴います:第1段階は、TLRなどのパターン認識レセプターによってPAMPやDAMPを認識するプライミングシグナルであり、これはインフラマソーム成分やプロ炎症性サイトカインpro-IL-1βとpro-IL-18の転写上昇を誘導します。第2段階は、イオンフロー、反応性酸素種、ミトコンドリア損傷などによって引き起こされる活性化ステップであり、NLRP3オリゴマー化、ASCリクルートメント、カスパーゼ-1活性化、pro-IL-1β/IL-18の生体内活性サイトカインへの切断を引き起こします。カスパーゼ-1はまた、ガスデルミンD(GSDMD)を切断し、そのN末端断片が細胞膜に孔を形成してピロプトーシス細胞死とサイトカイン放出を引き起こします。
蝸牛では、NLRP3インフラマソーム成分は主に常在マクロファージ、血管条帯の周縁細胞、支持細胞、螺旋神経節ニューロンに発現しており、この先天性免疫プラットフォームが蝸牛の恒常性と炎症病理学の中心に位置づけられています。NLRP3の活性化はIL-1βとIL-18の分泌を誘導し、炎症を広げ、毛細胞とニューロンの機能に不可欠な繊細な蝸牛微小環境を損なう可能性があります。
NLRP3インフラマソームが聴覚障害の病因に果たす役割
遺伝性聴覚障害と自己炎症性症候群
NLRP3遺伝子の変異は、冷感性家族性自己炎症性症候群(FCAS)、マッケルウェル症候群(MWS)、慢性乳児期神経皮膚骨格症候群(CINCA)を含むcryopyrin関連周期性症候群(CAPS)を引き起こし、これらの症候群ではしばしばセンソリニューラル聴覚障害が見られます。機能獲得変異は過剰なIL-1β産生、全身炎症、蝸牛自己炎症を引き起こします。CAPSの頻度は低いですが、診断遅延により過小評価されている可能性があります。対象解析や全エクソン配列解析によると、特定のNLRP3変異体は主に聴覚障害を引き起こし、明らかな全身症状なし(DFNA34と分類される)であることが示されています。これは炎症性聴覚表現型のスペクトルを強調しています。
患者由来のNLRP3変異を発現する動物モデルは、インフラマソーム活性化が蝸牛炎症と聴覚障害に果たす病態学的な役割を検証しています。ただし、一部のモデルでは重度の全身効果により早期聴覚表型化が制限されています。条件付きマウスモデルを使用して、蝸牛特異的に変異型NLRP3を発現させると、炎症と蝸牛構造の破壊に関連した重度の聴覚障害が見られ、人間の疾患特徴を再現しています。
獲得性および環境性聴覚障害
騒音性聴覚障害(NIHL)、加齢性聴覚障害(ARHL)、耳毒性薬物誘発性聴覚損傷において、NLRP3インフラマソーム活性化が実験的に示唆されています。騒音曝露は蝸牛からのDAMP放出を誘導し、インフラマソーム組み立てとIL-1β/IL-18の増加を引き起こします。薬理学的阻害は前臨床モデルで保護作用を示しています。ARHLは蝸牛でのインフラマソーム活性化の増加と相関しており、慢性低度炎症が加齢関連聴覚低下に寄与していることを示唆しています。
シスプラチンやアミノグリコシド系抗生物質は、NLRP3依存性活性化を介して耳毒性を誘発し、蝸牛毛細胞と周縁細胞でのピロプトーシスを促進します。注目すべきは、オリドンやMCC950などの化合物が、インフラマソーム組み立てと下流シグナル伝達を阻止することで耳毒性損傷を改善することが示されています。ウイルス感染(例:ヒトサイトメガロウイルス)もインフラマソームを介した蝸牛ニューロン死を引き起こし、先天性SNHLに寄与します。
他の内耳疾患
新興データは、メニエール病や前庭神経鞘腫に関連する聴覚障害におけるNLRP3インフラマソーム活性化との関連を示し、聴覚機能に影響を与える内耳炎症過程の広範な役割を強調しています。
聴覚障害におけるNLRP3インフラマソームの治療標的化
現在、CAPSのFDA承認治療薬には、anakinra(IL-1R拮抗薬)やcanakinumab(抗IL-1βモノクローナル抗体)が含まれており、特に早期に開始すると聴覚の安定化または改善に寄与します。rilonaceptやgevokizumabなどの実験的モノクローナル抗体が臨床評価中です。
MCC950やdapansutrilo(OLT1177)などの直接的なNLRP3阻害薬の前臨床および早期臨床の進展は、CAPSを超えた幅広いSNHL治療への有望な道を開いています。piceatannolやoridoninなどの天然化合物は、ARHL、NIHL、薬物誘発性耳毒性のモデルでインフラマソーム活性化とピロプトーシスを抑制することにより、免疫調節効果と耳保護効果を示しています。
tranylcypromineのインフラマソームシグナル伝達阻害効果を示す薬物再利用努力は、潜在的な治療選択肢を拡大しています。高度な症例では、聴覚補助装置が薬物療法に反応しない場合の重要な介入手段となります。
結論と今後の方向性
NLRP3インフラマソームは、遺伝的および実験的データが一致して、多様な起源を持つSNHLの中心的な病態学的メディエーターとして浮かび上がっています。聴覚の進行性低下を予防または停止するために、その治療標的化が支持されています。現在臨床開発中の新規選択的NLRP3阻害薬は、管理を変革する可能性のある新しいクラスの標的治療薬を告げています。今後の研究の重点は、これらの薬剤のヒト臨床試験での検証、早期検出のための信頼性のあるバイオマーカーの同定、抗炎症、抗酸化、再生療法を統合した組み合わせ戦略の探査です。これらにより聴覚保護の最適化を目指します。
分子イメージングや動物モデルの進歩により、機序的な洞察が加速され、インフラマソーム標的治療薬の臨床応用が促進され、数百万人の聴覚障害者に希望がもたらされます。
参考文献:
Murillo-Cuesta S, Seoane E, Cervantes B, Zubeldia JM, Varela-Nieto I. NLRP3 inflammasome and hearing loss: from mechanisms to therapies. J Neuroinflammation. 2025 Oct 4;22(1):225. doi: 10.1186/s12974-025-03561-w . PMID: 41046290 ; PMCID: PMC12497346 .



