ハイライト
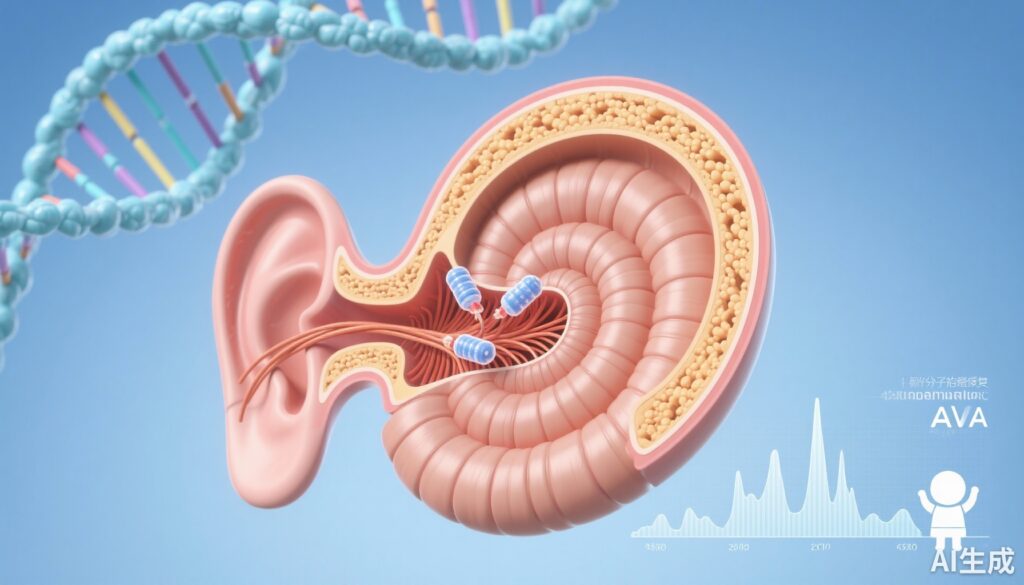
DB-OTOは、二つのAAV1ベクターを使用して毛細胞特異的な合成プロモーター(mMyo15)を用いた二重AAV遺伝子療法であり、内毛細胞でヒトOTOFバリアント5のフルレングスを再構築し、オトフェルリン欠損マウスにおいて少なくとも3ヶ月間、用量依存性かつ持続的な聴覚脳幹反応(ABR)の回復を達成しました。毛細胞制限発現は安全性にとって重要であり、これらの前臨床データは小児Phase I/II臨床試験への進行を支持しています。
背景:臨床的文脈と未充足のニーズ
OTOF(オトフェルリンをコード)の両等位遺伝子機能喪失変異は、DFNB9を引き起こします。これは非症候性先天性聴覚神経症を特徴とし、内毛細胞(IHCs)から蝸牛神経細胞への同期的なシナプス伝達が欠如または著しく低下する一方、多くの場合、耳音響放出が保たれます。影響を受けた乳児は通常、重度から極度の先天性または早期発症の聴覚障害を呈し、介入なしでは話言葉の発達が見られません。一般的な管理には、効果的であるものの手術と生涯のデバイス依存が必要な人工内耳植込みが含まれます。しかし、これは複雑な聴覚タスクにおける自然な音の符号化を完全に再現できない場合があります。したがって、欠損しているプレシナプス蛋白質を再構築し、おそらく内耳の固有構造と神経符号化を保存する分子療法の開発には強い根拠があります。
OTOFに対する遺伝子療法の開発には特定の課題があります。オトフェルリンは、複数のC2ドメインを持つ大きなタンパク質(複数のエクソンが6 kbを超えるコーディング配列をコード)であり、単一のアデノ随伴ウイルス(AAV)ベクターの包装容量を超えています。配達は効率的かつ安全にIHCsに到達する必要があり、発現は不適切なオトフェルリン発現を避けるために適切に細胞制限される必要があります。ヒトへの翻訳前の小動物モデルでの前臨床概念実証は、機能的救済と安全性の両方を評価するために不可欠でした。
研究設計と方法
Chungらの研究(Mol Ther Methods Clin Dev. 2025)では、二つのベクターで構成され、一緒にヒトOTOFバリアント5(hOTOFv5)のフルレングス発現カセットを再構築する二重AAV1遺伝子療法DB-OTOを評価しました。約1.0 kbのサイズの、マウスマイオシン15a規制要素からエンジニアリングされた合成毛細胞特異的プロモーター(mMyo15)が、IHCsでの制限発現を駆動するために使用されました。著者らは、このプロモーターを選択するために、GFPレポーターを用いてex vivoマウス耳蝸牛誘導培養でのプロモーター構成体の比較評価を行い、その後、野生型マウスとキビサルの体内検証により、転写の特異性と非ヒト霊長類への翻訳を評価しました。
治療用構築体は、確立された中耳配達経路を用いて新生OTOFノックアウトマウスに配達されました。研究では、10倍以上の用量範囲を探索し、用量依存性と安全性を評価しました。主要な機能的エンドポイントには、周辺聴覚経路の機能を標準的な電気生理学的測定として評価する聴覚脳幹反応(ABR)が含まれました。分子的エンドポイントには、IHCsでのオトフェルリンの免疫組織化学的検出と、汎用プロモーターと毛細胞特異的プロモーターを使用した際の異所性発現の評価が含まれました。持続性は投与後少なくとも3ヶ月間評価されました。
主要な知見
プロモーター選択と特異性:GFPレポーターを用いた誘導培養での複数のプロモーター構築体のスクリーニングを行いました。1.0 kbのmMyo15合成プロモーターは、汎用プロモーターと比較して、内毛細胞での強力で高レベルの発現と最小限のオフターゲット発現を達成しました。野生型マウスとキビサルでの体内検証では、毛細胞制限のトランスジェン発現が確認され、プロモーター設計の翻訳可能性が支持されました。
フルレングスOTOFの再構築:二重AAV1アプローチは、毛細胞での機能的なhOTOFv5発現カセットの再構築に成功しました。二つのベクター系は、単一のAAV容量を超えるコーディング配列を配達し、転写された毛細胞内で完全な発現カセットを再構築することにより、配列を配達しました。
機能的回復:DB-OTOは、オトフェルリン欠損マウスでの用量依存性のABR閾値の回復を達成しました。評価範囲内の治療用量では、治療群はIHCsからのシナプス伝達が再建されたことを示すABRの確立を示しました。救済の程度は用量とIHCsでのオトフェルリン発現の程度と相関していました。
持続性:機能的ABR回復とIHCsでのオトフェルリン発現は、評価された用量範囲全体で少なくとも3ヶ月間持続しました。この持続効果は、マウスモデルでの持続的な生物学的影響を示唆していますが、より長期の追跡調査と大型種での評価が必要です。
安全性とプロモーターの重要性:重要な安全性の知見は、毛細胞特異的発現が重要であるということです。汎用プロモーターによるhOTOFv5発現との比較では、安全性上の懸念が示され、IHCs外での異所性発現が有害である可能性があること、細胞制限がオフターゲット効果を軽減することを示唆しています。観察期間内では、治療群でオフターゲットの病態や重大な副作用は報告されていません。
翻訳検証:mMyo15プロモーターとAAV1カプシドは、キビサルでの毛細胞標的転写を生じさせ、ヒト試験への翻訳を支持するデータを提供しました。
解釈とメカニズム的洞察
オトフェルリンは、内毛細胞シナプスでのカルシウムセンサーおよび膜融合促進因子として機能し、高忠実度の聴覚信号伝達に必要な急速かつ持続的なシナプス小胞の補充をサポートすると考えられています。したがって、IHCsでのオトフェルリン発現の再構築は、同期的なニューロトランスミッター放出の再建と音に対する神経応答の改善につながるべきです。現在の研究は、このメカニズム的前提を示しています:IHCsでのオトフェルリンの分子的再構築は、シナプス機能の回復を示す電気生理学的証拠と相関していました。
二重AAVアプローチは、OTOFコーディング配列の大きさという重要な技術的障壁に対処し、治療用カセットを二つの部分で配達することで、単一のAAV容量を超えるコーディング配列を配達します。このような戦略の成功は、標的細胞の共転写効率と正確な再構築に依存し、評価された用量では新生マウスの内耳で十分な効果が得られました。
臨床的および翻訳的考慮事項
これらの前臨床結果は、OTOF関連の聴覚障害を有する小児患者を対象としたPhase I/II臨床試験の開始を支持しました。医師と試験実施者が重視すべきいくつかの翻訳的側面があります:
- 介入の窓:早期治療は有利であると考えられます。聴覚経路と言語の発達は早期の感覚入力に依存します。新生児スクリーニングで識別された前言語期患者は最適な候補となる可能性があります。
- 配達経路と麻酔:ヒトでは手術条件下での耳蝸牛内または円窗配達が必要です。術中および麻酔の安全性は慎重な計画を要します。
- 免疫に関する考慮事項:既存のAAV1カプシドに対する免疫や治療誘発免疫が効果や再投与に影響を与える可能性があります。スクリーニングと管理計画は試験設計の一部となるべきです。
- 評価指標:ABRは堅牢な電気生理学的エンドポイントですが、臨床試験には包括的な聴力評価(年齢に応じて行動聴力測定)、言語・言葉の結果、患者または保護者報告の機能的指標を含めるべきです。
- 持続性とスケーリング:マウスの寿命と免疫反応はヒトとは異なるため、長期的な追跡調査と非ヒト霊長類データが臨床設定での持続性と安全性を示すのに役立ちます。
制限と未解決の問題
いくつかの留意点により、マウスデータを直接ヒトの臨床的利益に外挿することは制限されます。まず、ヒトIHCsでの共転写効率と再構築率はまだ完全に特徴付けられていません。内耳の大きさと構造の違いがベクター分布に影響を与える可能性があります。次に、マウスでの3ヶ月間の持続性は、生涯にわたる聴覚の需要に対する短い時間枠です。第三に、より長期の安全性、特に異所性発現やベクター関連の免疫病理の可能性については継続的な監視が必要です。最後に、マウスでの機能的回復は主にABRで評価されていますが、再構築されたオトフェルリンが複雑な聴覚処理、両耳聴覚、乳児の言語結果をどの程度回復するかは未知であり、臨床的に確立する必要があります。
専門家コメント
本研究は、毛細胞特異性を達成するための合理的なプロモーター工学、サイズ制約を克服するための実用的な二重ベクター設計、非ヒト霊長類を含むクロススペーシーズ検証という、慎重な翻訳的進行を代表しています。DFNB9を患う小児を診療する医師にとって、これらのデータは、大規模なプレシナプス蛋白質の遺伝子置換が末梢聴覚生理学を再建できるという最も直接的な前臨床的証拠です。毛細胞特異的発現の強調は、遺伝子療法開発においてしばしば軽視される実用的な安全性の問題に答えています。
ただし、医師は家族に対して、早期フェーズの試験は主に安全性と生物学的効力の評価を行うため、話言葉の回復や実世界の聴覚機能は、発達指標を含む長期的な臨床研究によってのみ明らかになると助言する必要があります。人工内耳植込みは予測可能な結果を持つエビデンスベースの選択肢であり、共有意思決定の議論の一環であるべきです。
結論と将来の方向性
DB-OTOは、毛細胞特異的プロモーターと組み合わせたフルレングスhOTOFv5の二重AAV配達が、オトフェルリン欠損マウスの聴覚生理学を回復し持続させることの原理を証明しています。毛細胞標的発現は、広範なトランスジェン発現に関連する安全性の懸念を軽減します。これらの前臨床データは、OTOF関連難聴を有する小児患者を対象とする進行中のPhase I/II臨床試験の基盤となり、先天性聴覚シナプトパシーの遺伝子に基づく自然な内耳機能の回復に向けた重要な一歩を表しています。
今後の主要な優先事項には、臨床集団での長期的な安全性と効力のモニタリング、ヒト内耳解剖学に最適化された配達手法の最適化、実世界の聴覚と言語結果の評価、既存の抗AAV免疫への対策戦略が含まれます。臨床試験が有意な利益と許容可能な安全性を示せば、DB-OTOや同様のアプローチは、先天性聴覚シナプトパシーを有する小児の治療選択肢を拡大し、プロスティックデバイスへの依存を低減し、発達結果を改善する可能性があります。
資金提供とclinicaltrials.gov
Chungらは、論文で記載されている機関およびスポンサーの支援を認めています。研究の結果は、Phase I/II試験の開始に直接寄与しました。医師と家族は、登録識別子と最新の登録情報のためにclinicaltrials.govレジストリと試験固有の資料を参照するべきです。
参考文献
1. Chung Y, Koehler SD, Cancelarich S, et al. Functional, sustained recovery of hearing in Otoferlin-deficient mice using DB-OTO, a hair-cell-specific AAV-based gene therapy. Mol Ther Methods Clin Dev. 2025 Aug 25;33(4):101577. doi: 10.1016/j.omtm.2025.101577. PMID: 41036103; PMCID: PMC12481892.
2. Varga R, Jennings B, Hibbard L, et al. Mutations in OTOF, encoding otoferlin, cause DFNB9, a recessive form of nonsyndromic deafness. Nat Genet. 2003;35(3):258–264. (ヒトの先天性難聴の原因としてOTOFを特定した基礎的な研究)
3. World Health Organization. Deafness and hearing loss. WHO fact sheet. Updated 2021. https://www.who.int/news-room/fact-sheets/detail/deafness-and-hearing-loss (2025年にアクセス)