Những điểm nổi bật
- Xác định biến thể L858R EGFR di truyền và somatic là nguyên nhân của một hội chứng riêng biệt liên quan đến acanthosis nigricans (AN) tổng quát và bệnh lý phổi.
- Các dấu hiệu lâm sàng bao gồm dày da sớm ở vùng gập, tăng sắc tố quanh miệng, tóc rối, và keratoderma lòng bàn tay và chân.
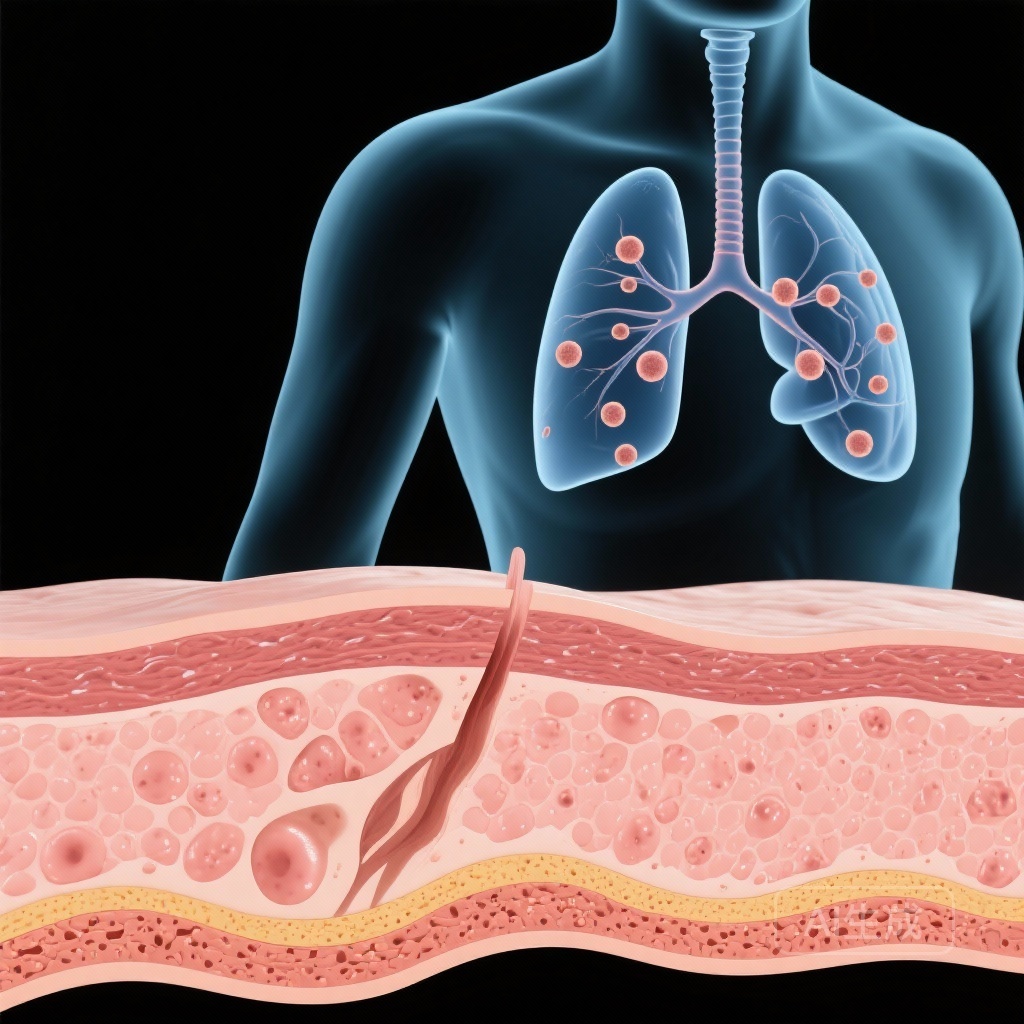
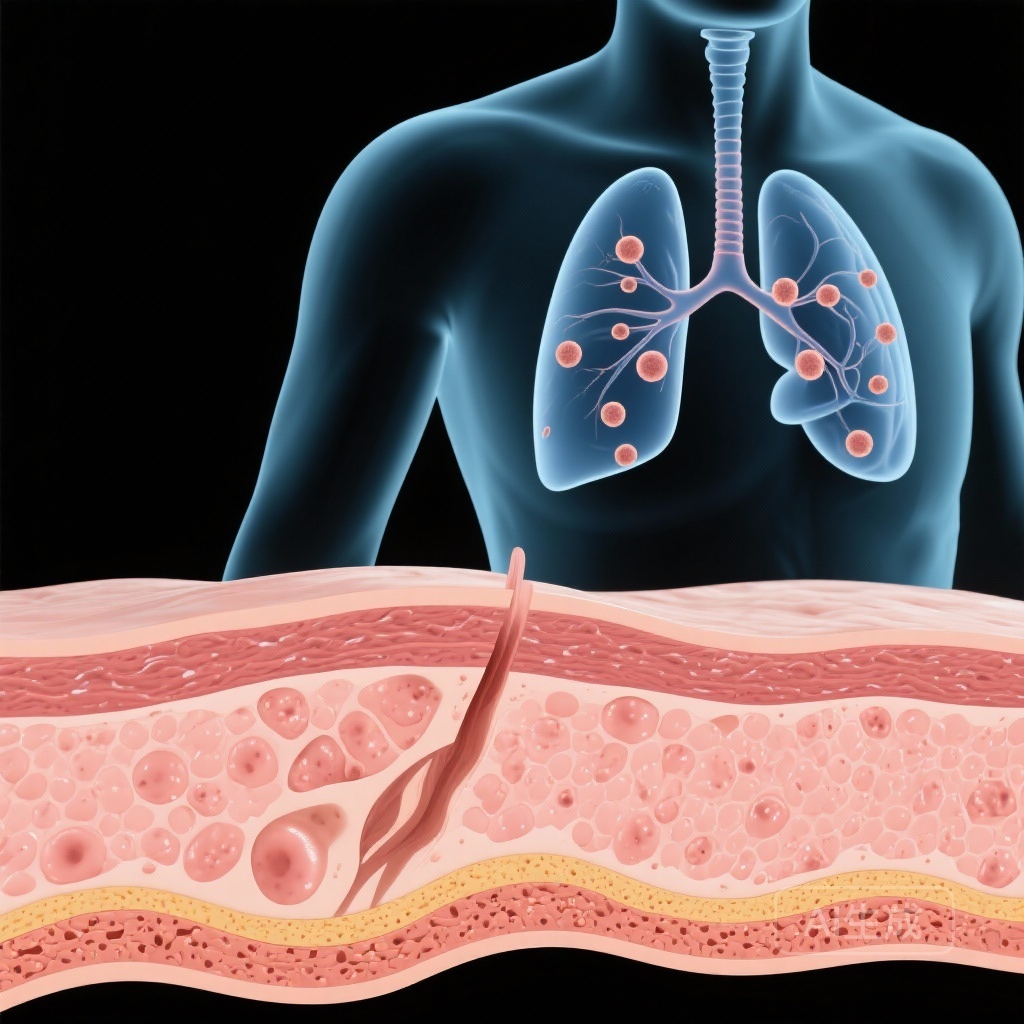
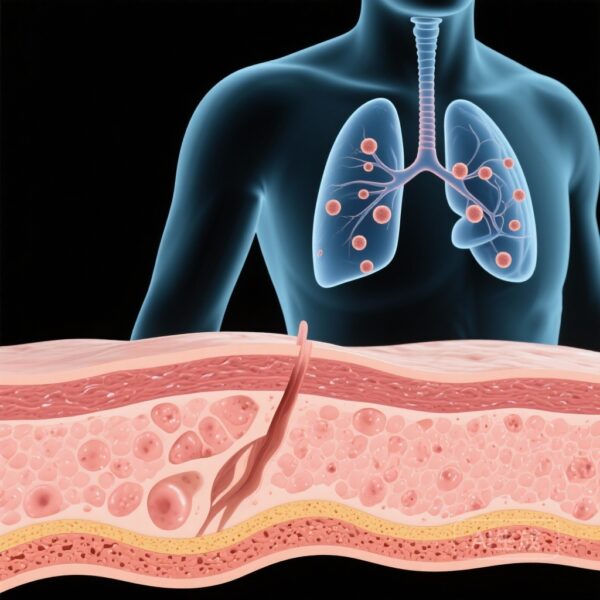
- Phát hiện u nốt phổi ở những người bị ảnh hưởng, có thể là tiền chất của ung thư phế quản.
- Chứng minh sự hồi phục gần như hoàn toàn của cả các triệu chứng da và phổi sau khi điều trị hệ thống bằng chất ức chế tyrosine kinase EGFR (TKIs).
Nền tảng
Acanthosis nigricans (AN) là một dấu hiệu da phổ biến thường liên quan đến đề kháng insulin, béo phì và rối loạn nội tiết. Tuy nhiên, khi AN xuất hiện sớm trong cuộc đời, tổng quát hoặc xảy ra mà không có tăng đường huyết, nó có thể là dấu hiệu của một hội chứng di truyền hoặc bệnh ác tính bên trong. Mặc dù các biến thể tăng cường chức năng trong thụ thể yếu tố tăng trưởng biểu bì (EGFR) đã được ghi nhận là nguyên nhân gây ra ung thư phổi tế bào không nhỏ (NSCLC), nhưng vai trò của chúng trong gây ra bệnh da hệ thống, hội chứng vẫn chưa được xác định rõ ràng cho đến gần đây.
Đường dẫn EGFR là quan trọng đối với sự phân chia và biệt hóa của keratinocyte. Sự hoạt hóa quá mức của đường dẫn này thông qua các đột biến somatic là đặc trưng của quá trình sinh ung thư, nhưng các đột biến de novo di truyền—cụ thể là thay thế L858R ở exon 21—đặt ra một thách thức lâm sàng độc đáo. Nghiên cứu này điều tra cơ sở di truyền của AN hội chứng nặng, xuất hiện sớm và khám phá tiềm năng điều trị của liệu pháp hướng vào cơ chế bệnh lý sử dụng chất ức chế EGFR.
Thiết kế nghiên cứu
Nghiên cứu này bao gồm ba trường hợp với các biểu hiện lâm sàng khác nhau của dày da và tăng sắc tố nặng. Hai cá nhân có đường huyết bình thường và tăng sắc tố quanh miệng xuất hiện sớm, sau đó tiến triển thành dày da tổng quát ở vùng gập. Trường hợp thứ ba ban đầu được chẩn đoán là nevus biểu bì lan rộng. Độ tuổi của các trường hợp dao động từ 8 đến 18 tuổi.
Đội ngũ nghiên cứu áp dụng phương pháp đa ngành để đặc trưng hóa bệnh:
-
Phân tích di truyền:
Phân tích toàn bộ exome (WES) được thực hiện trên mẫu máu và da để xác định các biến thể gây bệnh.
-
Thẩm định phân tử:
Các nghiên cứu được tiến hành trên các mô da bị ảnh hưởng và keratinocyte nuôi cấy để đánh giá sự hoạt hóa của đường dẫn EGFR, cụ thể là các phân tử tín hiệu下游 nhưMAPK。
-
评估:
参与者接受了全面的肺功能测试和高分辨率肺部成像(CT扫描),以筛查全身受累情况。
-
治疗干预:
研究监测了这些患者对系统性EGFR抑制剂治疗的临床反应,评估皮肤质地和肺结节负担的变化。
主要发现
基因组和分子驱动因素
所有三名参与者都被发现携带EGFR L858R变体。在两名有广泛皮肤受累的病例中,该变体是de novo种系的,而表现为局部表皮痣的个体则表现出嵌合体somatic变体。对病变皮肤和培养的角质细胞的分析证实了EGFR通路活动的显著增加。体外药理学抑制成功地抑制了这种过度激活,为系统性治疗提供了依据。
表型表现
在种系病例中,临床表现非常一致。主要特征包括:
- 广泛的获得性角化病,在褶皱部位(腋窝、颈部、腹股沟)显著加重。
- 羊毛状头发质地和掌跖角化病。
- 早期出现的口周色素沉着。
至关重要的是,研究发现了显著的肺部受累。肺部成像显示参与者存在多个肺结节。鉴于L858R变体是已知的肺腺癌驱动因子,这些结节被认为是前驱病变,使这些年轻患者面临极高的终身肺恶性肿瘤风险。
EGFR抑制的治疗效果
从分子发现到临床应用的转变带来了戏剧性的结果。接受系统性EGFR抑制剂(如厄洛替尼或吉非替尼)治疗的患者皮肤疾病显著消退。更重要的是,随访成像显示肺结节数量和大小的减少或消失。这表明TKIs可以作为这一患者群体的治疗和预防措施。
专家评论
这项研究重新定义了我们对EGFR信号传导与皮肤生理关系的理解。在临床医学的背景下,“EGFR-AN综合征”的确定为儿科皮肤病学家和肿瘤学家提供了一个关键的诊断框架。当医生遇到代谢正常的患者出现广泛的AN时,应考虑进行EGFR变体的基因筛查。
L858R变体与观察到的表型之间的机制联系在生物学上是合理的。EGFR信号传导促进棘层的扩展并抑制终末分化,导致皮肤的过度角化和棘层增厚。在肺部,同样的突变促进了肺泡上皮细胞的克隆扩张,导致结节形成。本研究中TKI治疗的成功突显了精准医学的力量:通过靶向特定的分子驱动因子,临床医生可以同时治疗可见的皮肤疾病和潜在的生命威胁性肺前驱病变。
结论
Jiang等人的研究表明,de novo种系L858R EGFR变体导致一个多系统综合征,其特征是广泛的acanthosis nigricans和高肺部疾病风险。这一发现将严重AN的诊断范式从代谢焦点转向基因组焦点。早期识别至关重要,因为它允许启动针对EGFR的治疗,该治疗在逆转皮肤表现方面显示出显著效果,并可能防止肺结节进展为侵袭性腺癌。需要进一步的长期研究来确定TKI治疗的最佳持续时间和这些患者的长期预后。
参考文献
Jiang X, Jeng MY, Yang Z, et al. De Novo Germline L858R EGFR Variants and Generalized Acanthosis Nigricans. JAMA Dermatol. Published online January 14, 2026. doi:10.1001/jamadermatol.2025.5414