ハイライト
- 急性悪化(AD)および急性持続性肝不全(ACLF)患者において、血漿中のRIPK3レベルが上昇すると多臓器障害と死亡率を強く予測します。
- RIPK3は他の細胞死マーカーを凌駕し、肝硬変悪化時の肝機能障害と腎機能障害との相関関係を示します。
- RIPK3、CLIF-C 脏器障害スコア、白血球数を組み込んだ新しい死亡予測モデルは、高い診断精度と外部検証を示します。
- ACLFでの肝RIPK1発現の増加は、ネクロトーシス経路が疾患進行と死亡率に寄与することを示し、標的療法戦略を可能にします。
研究背景
肝硬変の急性悪化(AD)とその重症形態である急性持続性肝不全(ACLF)は、急速な悪化と短期間での高死亡率という重要な臨床的課題を呈しています。現在の予後ツールは主にCLIF-C 脏器障害スコアなどの臨床スコアリングシステムに依存していますが、個人の結果を予測する点で完全ではありません。最近の研究では、受容体相互作用タンパク質キナーゼRIPK1とRIPK3によって媒介される制御されたネクロトーシスが、肝硬変における肝損傷、全身炎症、臓器障害、死亡の主要なメカニズムであることが示されています。しかし、ネクロトーシスマーカーの予後ツールとしての臨床応用には堅牢な検証が欠けていました。この研究では、Vermaらがこのギャップに対処し、血漿RIPK3を新しい予後バイオマーカーとして同定し、検証しました。
研究デザイン
この前向き多施設研究では、肝硬変の急性悪化患者200人を対象とした導出コホートが登録されました。そのうち153人がACLFでした。基線と7日目という2つの時間点で、プログラム細胞死のマーカー(シトケラチン-18断片M30(アポトーシス)、M65(総細胞死)、RIPK3、MLKL(ネクロトーシスの主要実行者)、ガスデルミンD(ピロトーシス))を血漿から測定しました。臨床データには、臓器障害スコアと検査パラメータが含まれました。RIPK3レベル、CLIF-C 脏器障害(OF)スコア、白血球数の異常を用いて死亡予測モデルが構築され、その性能は合計356人の3つの独立したコホートで外部検証されました。さらに、別のAD/ACLFコホート(n=21)の肝生検組織をRIPK1とネクロトーシスマーカーに対する免疫組織化学染色を行い、肝内発現と結果の関連を評価しました。
主要な知見
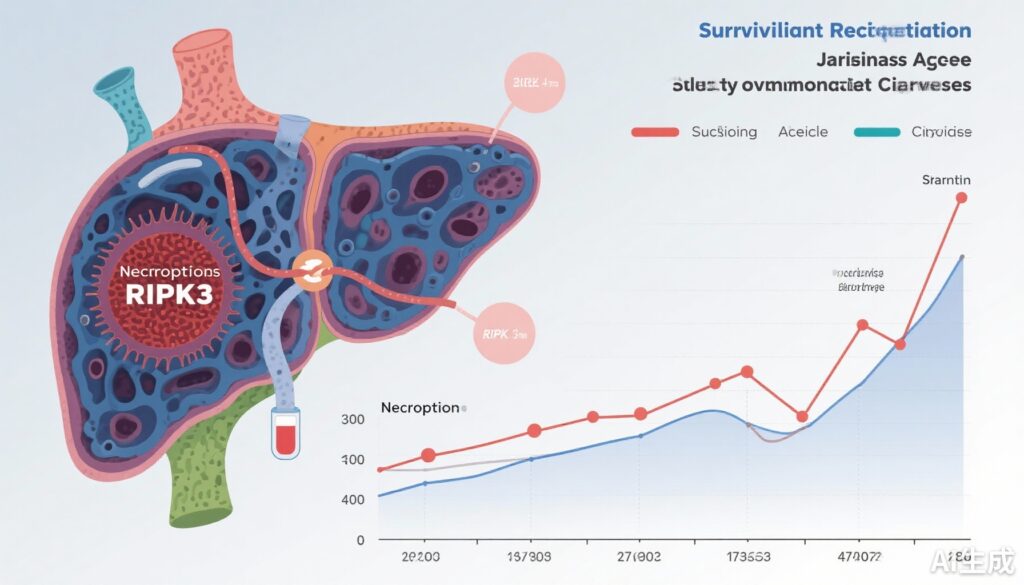
すべての細胞死マーカーの血漿レベルは、疾患の重症度が増すにつれて上昇しました。特に、RIPK3は多臓器障害、特に肝機能障害と腎機能障害(それぞれp <0.05)との最強の相関関係を示しました。基線RIPK3が正常上限値(ULN)の2.261倍を超えると、疾患進行(調整済みオッズ比 [aOR] 4.85;95%信頼区間 [CI] 2.36-9.94;p <0.001)と死亡(aOR 4.74;95% CI 2.38-9.44;p <0.001)との独立した関連性が示されました。
RIPK3の動的変化は臨床軌道と相関していました:上昇するレベルは悪化する臓器機能障害と死亡を予測し、下がるレベルは生存者における臨床的改善と関連していました(p <0.001)。
RIPK3、CLIF-C OF、白血球増多または減少を組み込んだ死亡予測モデルは、導出コホート(AUC 0.839)で強い識別力を示し、2つの外部検証コホート(AUC 0.752と0.794)でも堅牢さが維持されました。3つ目のコホートでの時間的検証は、モデルの適用可能性を確認しました(AUC 0.796)。
組織分析では、ACLF患者の肝RIPK1発現が単独のAD患者よりも有意に増加していました。高い肝RIPK1レベルは死亡と相関しており、肝内のネクロトーシスシグナル伝達が直接臓器障害と不良結果に寄与することを支持しています。
専門家のコメント
この研究は、RIPK3をAD/ACLFにおけるネクロトーシス細胞死経路を反映する臨床的に実践可能なバイオマーカーとして検証することで、説得力のある翻訳研究の進展をもたらします。血漿RIPK3と進行および死亡との強い独立した関連性は、ネクロトーシスが病原性のドライバーであり、潜在的な治療標的であることを強調しています。アポトーシスマーカーとは異なり、RIPK3はネクロトーシスを特異的に識別し、肝硬変における全身炎症を悪化させるプロ炎症性の細胞死モードを示します。
血漿バイオマーカーの定量と組織病理学的確認を組み合わせた多層アプローチは、生物学的妥当性を強化します。RIPK3を予後スコアに組み込むことで、従来の臓器障害スコアだけでは達成できない予測精度が向上し、より良いリスク分類が可能になります。
制限点には、比較的小規模な生検サンプルサイズと、多様な人口や併存症における長期的検証の必要性が含まれます。また、RIPK3測定を日常臨床使用に移行するには、検査の標準化と費用対効果の評価が必要です。
RIPK1/RIPK3の関与に関する機構的洞察は、ネクロトーシスの薬理学的阻害が臓器損傷を軽減できることを示唆し、ADとACLFにおけるこの経路を標的とする臨床試験の道を開きます。
結論
Vermaらは、急性悪化と急性持続性肝不全における臓器障害と死亡の予測バイオマーカーとして、RIPK3を新たな、堅牢なバイオマーカーとして確立しました。予後モデルに組み込むことで、リスク分類が大幅に向上し、より個別化された患者管理が可能になります。本研究はまた、ネクロトーシスが疾患進行に寄与する主要な病理学的メカニズムであることを検証し、肝RIPK1発現が肝内関与をさらに裏付けています。これらの知見は、高リスクの肝硬変患者に対する将来のネクロトーシス標的療法の基盤を築き、機序に基づく介入によりADとACLFの結果を改善する有望な方向性を示しています。
資金提供と試験登録
本研究は、肝臓学研究を支援する機関からの助成金と学術団体によって資金提供されました。この観察的バイオマーカー研究には、臨床試験登録番号は報告されていません。
参考文献
Verma N, Garg P, Kaur P, Munjal S, Vinod AP, Valsan A, Andreola F, Kumar P, Saeidinejad M, Engelmann C, De A, Premkumar M, Taneja S, Mookerjee RP, Duseja A, Jalan R. Identification and validation of RIPK3 as a novel biomarker to predict outcomes in patients with acute decompensation of cirrhosis. J Hepatol. 2025 Aug 12:S0168-8278(25)02405-5. doi: 10.1016/j.jhep.2025.07.034. Epub ahead of print. PMID: 40812668.