Nhấn mạnh
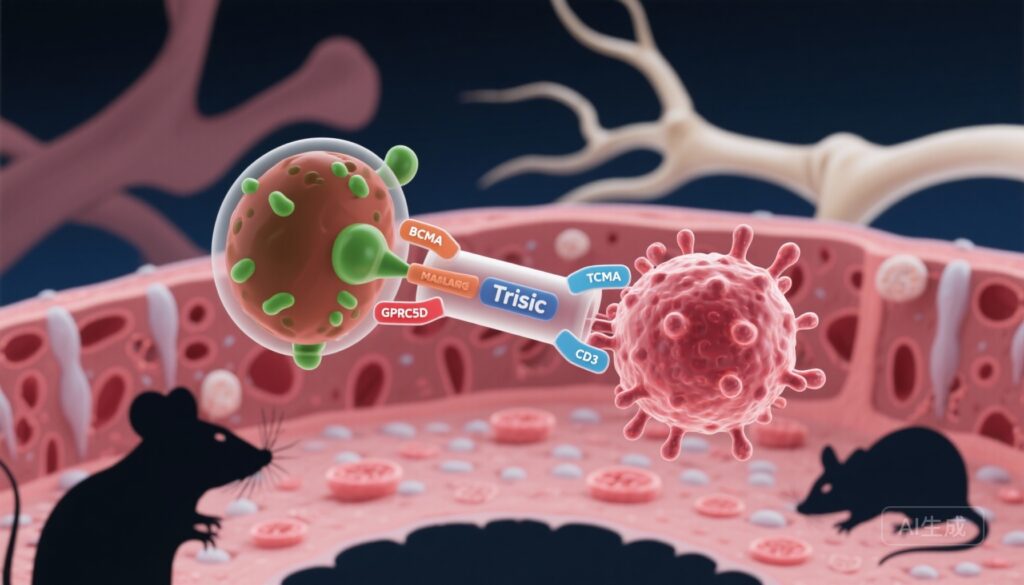
– Ramantamig (JNJ-79635322) là một trispecific T-cell engager hướng đến BCMA, GPRC5D, và CD3 được thiết kế để tăng cường khả năng gắn kết khối u và vượt qua sự kháng thuốc do mất kháng nguyên trong bệnh bạch huyết tế bào tương (MM).
– Trong các mô hình tiền lâm sàng, ramantamig tạo ra độc tính tế bào mạnh mẽ ở nồng độ dưới nanomol, làm giảm tế bào tương bạch huyết ác tính trong các thử nghiệm in vitro và toàn máu, và thể hiện hoạt động phòng ngừa và hồi phục khối u trong các mô hình xenograft chuột.
– Dữ liệu này hỗ trợ việc chuyển đổi lâm sàng; hai thử nghiệm lâm sàng giai đoạn 1 trong bệnh bạch huyết tế bào tương tái phát/kháng trị (NCT05652335, NCT06768489) đang tiến hành để đánh giá an toàn, khả năng chịu đựng, dược động học, và hiệu quả ban đầu.
Nền tảng và nhu cầu chưa đáp ứng
Bệnh bạch huyết tế bào tương là một bệnh ác tính của tế bào tương bạch huyết, đặc trưng bởi sự sinh sôi không kiểm soát trong tủy xương, tiến hóa gen liên tục, và tái phát thường xuyên bất chấp các phương pháp điều trị tiếp theo. Các liệu pháp miễn dịch hướng kháng nguyên thu hút tế bào T nội sinh—như bispecific T-cell engagers và tế bào T CAR—đã cải thiện kết quả cho một số bệnh nhân, đặc biệt là những người nhắm vào kháng nguyên trưởng thành tế bào B (BCMA). Tuy nhiên, việc kiểm soát bền vững vẫn khó khăn do sự đa dạng của khối u, giảm hoặc mất kháng nguyên, và môi trường tủy xương ức chế miễn dịch.
Các phương pháp nhắm mục tiêu kép nhằm giảm sự thoát khỏi kháng nguyên và tăng cường sự gắn kết mục tiêu thông qua hiệu ứng độ bám dính. GPRC5D (G protein–coupled receptor class C group 5 member D) đã xuất hiện như một kháng nguyên myeloma bổ sung với biểu hiện cao trên tế bào tương bạch huyết và mô hình riêng biệt từ BCMA, cung cấp lý do cho việc nhắm mục tiêu đồng thời. Các cấu trúc trispecific kết hợp hai kháng nguyên khối u và CD3 trên tế bào T được thiết kế để tăng cường độ chọn lọc cho tế bào tương bạch huyết ác tính, tăng cường khả năng độc tính tế bào, và giảm cơ hội cho tế bào khối u thoát qua mất một kháng nguyên.
Thiết kế Nghiên cứu (Tổng quan Tiền Lâm Sàng)
Bài báo của Pillarisetti et al. mô tả sự đặc trưng tiền lâm sàng của ramantamig (JNJ-79635322), một kháng thể trispecific kết hợp BCMA và GPRC5D trên tế bào mục tiêu và CD3 trên tế bào T. Việc đánh giá bao gồm các thử nghiệm độc tính tế bào in vitro đối với các dòng tế bào được thiết kế và bệnh bạch huyết tế bào tương, các thử nghiệm kích hoạt tế bào T, các thí nghiệm co-culture in vitro với mẫu tủy xương chính từ bệnh nhân, các thí nghiệm co-culture toàn máu sử dụng máu của người hiến khỏe mạnh với tế bào bạch huyết được thêm vào, và các nghiên cứu hiệu quả in vivo trong các mô hình xenograft chuột miễn dịch suy giảm bao gồm cả mô hình phòng ngừa và hồi phục.
Các điểm cuối thí nghiệm quan trọng bao gồm khả năng tiêu diệt tế bào khối u (EC50), các dấu hiệu kích hoạt tế bào T và giải phóng cytokine, làm giảm tế bào tương bạch huyết ác tính trong các mẫu từ bệnh nhân, và ức chế và hồi phục sự tăng trưởng khối u trong các mô hình chuột. Hoạt động của cấu trúc đối với các dòng tế bào biểu hiện một hoặc cả hai kháng nguyên đã được thử nghiệm cụ thể để kiểm tra giá trị bổ sung của việc nhắm mục tiêu kép.
Kết quả Chính
Hiệu lực in vitro và kích hoạt tế bào T
Ramantamig gây ra độc tính tế bào mạnh mẽ, phụ thuộc vào nồng độ, trong các dòng tế bào bệnh bạch huyết tế bào tương ở nồng độ dưới nanomol, nhất quán với hiệu quả chức năng cao. Cấu trúc trispecific kích hoạt tế bào T (tăng cường các dấu hiệu kích hoạt và sản xuất cytokine tác nhân) song song với sự tiêu diệt tế bào khối u. Quan trọng, ramantamig thể hiện hoạt động đối với cả các dòng tế bào bạch huyết biểu hiện cả hai kháng nguyên và chỉ một kháng nguyên, cho thấy cấu trúc có thể gây độc tế bào khi BCMA hoặc GPRC5D có mặt.
Làm giảm tế bào tương bạch huyết ác tính của bệnh nhân in vitro
Trong một thí nghiệm co-culture tế bào T in vitro sử dụng mẫu tủy xương từ bệnh nhân mắc bệnh bạch huyết tế bào tương, ramantamig tạo ra sự giảm tế bào tương bạch huyết ác tính phụ thuộc vào liều. Khả năng giảm dân số tế bào tương bạch huyết clonal trong vật liệu chính là một tín hiệu chuyển đổi quan trọng, hỗ trợ khả năng của cấu trúc để thu hút tế bào T nội sinh của con người và nhắm mục tiêu các tế bào bệnh lý liên quan đến lâm sàng.
Co-culture toàn máu—môi trường sinh lý
Để xấp xỉ một môi trường sinh lý hơn, các tác giả sử dụng máu toàn phần tươi từ người hiến khỏe mạnh co-culture với tế bào bạch huyết H929. Trong các điều kiện này, ramantamig cũng gây ra sự giảm tế bào khối u phụ thuộc vào liều, gợi ý hoạt động chức năng trong sự hiện diện của các thành phần máu khác và có thể phản ánh các khía cạnh của sự thu hút mục tiêu và chức năng tác nhân trong tuần hoàn.
Hiệu quả in vivo trong các mô hình xenograft
Ramantamig thể hiện hiệu quả chống khối u mạnh mẽ trong các mô hình xenograft chuột. Trong một mô hình phòng ngừa sử dụng các tế bào clonal biểu hiện mục tiêu đơn, ramantamig ngăn chặn sự hình thành khối u. Trong hai mô hình hồi phục, chất trispecific gây ra sự thu nhỏ khối u, hỗ trợ hoạt động trong cả bối cảnh dự phòng và điều trị in vivo. Cũng như hầu hết các nghiên cứu xenograft, các mô hình này sử dụng chuột miễn dịch suy giảm được tái tạo bằng tế bào T của con người hoặc dựa vào chuyển giao thích ứng để cung cấp các tế bào tác nhân; tuy nhiên, chúng cung cấp một bằng chứng quan trọng về hiệu quả chống khối u in vivo.
Coverage kháng nguyên và xem xét sự kháng thuốc
Hoạt động của cấu trúc đối với cả các tế bào biểu hiện kháng nguyên đơn và kép là một quan sát cơ chế quan trọng. Nhắm mục tiêu kép tăng cơ hội nhận biết các quần thể clonal đa dạng trong tủy xương và giảm áp lực chọn lọc ủng hộ các tế bào đã giảm một mục tiêu kháng nguyên. Các đặc điểm này có thể chuyển thành các đợt thuyên giảm sâu và bền vững hơn nếu được xác nhận trong bệnh nhân.
Tín hiệu An toàn và Xem xét Chuyển đổi
Công việc tiền lâm sàng tập trung vào hiệu quả và cơ chế; các đánh giá an toàn và độc tính chi tiết sẽ yêu cầu dữ liệu lâm sàng. Tuy nhiên, một số xem xét chuyển đổi quan trọng xuất hiện:
- Tác động trên mục tiêu, ngoài khối u: Cả BCMA và GPRC5D đều phong phú trên tế bào tương bạch huyết, nhưng sự giảm tế bào tương bạch huyết bình thường là một tác động trên mục tiêu được dự kiến. Biểu hiện GPRC5D cũng đã được liên kết với các mô sừng hóa (ví dụ, nang tóc và móng tay) trong một số nghiên cứu; kinh nghiệm lâm sàng với bispecific nhắm mục tiêu GPRC5D đã báo cáo các dị tật da và móng, cần phải theo dõi.
- Giải phóng cytokine và độc tính thần kinh: Các liệu pháp kết hợp CD3 thường gây ra hội chứng giải phóng cytokine (CRS) và, ít thường xuyên hơn, hội chứng độc tính thần kinh tế bào tác nhân miễn dịch (ICANS). Mức độ và thời gian của các sự kiện này phụ thuộc vào liều lượng, đường dùng, và các đặc điểm cụ thể của cấu trúc (độ kết dính và đa dạng) và phải được đánh giá trong các thử nghiệm giai đoạn sớm.
- Khả năng hoạt động và kiệt sức của tế bào T: Sự kiểm soát khối u bền vững yêu cầu chức năng tế bào T lâu dài. Sự kích hoạt tế bào T lặp đi lặp lại hoặc kéo dài có thể dẫn đến kiệt sức; các chiến lược kết hợp hoặc điều trị theo thứ tự có thể cần thiết để bảo tồn hoặc tái kích hoạt chức năng tác nhân.
- Dược động học và liều lượng: Các phân tử trispecific có thể có các hồ sơ dược động học (PK) khác biệt so với bispecifics hoặc kháng thể đơn dòng. Các chế độ liều tối ưu để tối đa hóa hiệu quả đồng thời hạn chế độc tính sẽ được xác định trong các nghiên cứu giai đoạn 1.
Bình luận của Chuyên gia và Hạn Chế
Ramantamig đại diện cho một sự mở rộng hợp lý của mô hình nhắm mục tiêu kháng nguyên trong bệnh bạch huyết tế bào tương: bằng cách thu hút hai kháng nguyên liên quan đến khối u không giống nhau và thu hút tế bào T, trispecifics nhằm cải thiện độ chọn lọc khối u và giảm sự kháng thuốc. Bộ dữ liệu tiền lâm sàng được trình bày cho thấy hiệu quả đáng khích lệ trong nhiều thí nghiệm bổ sung, bao gồm cả vật liệu từ bệnh nhân—một bước chuyển đổi quan trọng hơn công việc chỉ dựa trên dòng tế bào.
Tuy nhiên, các hạn chế quan trọng làm giảm sự hào hứng chờ đợi dữ liệu lâm sàng. Các mô hình xenograft tiền lâm sàng không tái tạo đầy đủ môi trường tủy xương của con người, các tín hiệu điều hòa miễn dịch, hoặc động lực dài hạn của tương tác miễn dịch-khối u. Hồ sơ an toàn không thể suy ra từ các nghiên cứu hiệu quả; các chất kết hợp CD3 thường yêu cầu tăng liều cẩn thận và các chiến lược giảm nhẹ CRS (ví dụ, tăng liều dần, sẵn sàng chặn corticosteroid hoặc IL-6). Cuối cùng, độ phức tạp sản xuất và hành vi dược động học của trispecifics có thể ảnh hưởng đến khả năng mở rộng và triển khai lâm sàng.
Phát triển Lâm sàng và Các Bước Tiếp Theo
Bộ dữ liệu tiền lâm sàng đã hỗ trợ việc khởi động các thử nghiệm lâm sàng giai đoạn 1 trong bệnh bạch huyết tế bào tương tái phát/kháng trị: NCT05652335 và NCT06768489. Các nghiên cứu này sẽ xác định liều tối đa có thể chịu đựng (MTD) hoặc liều khuyến nghị giai đoạn 2 (RP2D), đặc trưng an toàn (với nhấn mạnh vào CRS, độc tính thần kinh, và tác động ngoài khối u), đánh giá dược động học và dược động học, và cung cấp các tín hiệu hiệu quả ban đầu bao gồm tỷ lệ đáp ứng và đánh giá bệnh còn lại tối thiểu (MRD).
Các câu hỏi lâm sàng trong tương lai bao gồm vị trí của các chất trispecific so với các phương thức hiện tại nhắm mục tiêu BCMA (tế bào T CAR, bispecifics, kháng thể kết hợp thuốc), liệu chúng có thể cứu chữa các bệnh nhân tái phát sau khi điều trị nhắm mục tiêu BCMA, và liệu các kết hợp hợp lý với điều chỉnh điểm kiểm tra, tác nhân kích hoạt miễn dịch, hoặc tác nhân nhắm mục tiêu môi trường vi mô có thể tăng cường độ bền.
Kết luận
Ramantamig (JNJ-79635322) là một trispecific T-cell engager hứa hẹn nhắm vào BCMA và GPRC5D với hoạt động chống bệnh bạch huyết tế bào tương mạnh mẽ trong các mô hình in vitro, in vitro, và in vivo. Khả năng của cấu trúc để nhắm mục tiêu các tế bào biểu hiện kháng nguyên đơn và kép cung cấp lợi thế cơ chế để giải quyết sự đa dạng của khối u và sự kháng thuốc do mất kháng nguyên. Các thử nghiệm lâm sàng giai đoạn 1 đang tiến hành sẽ rất quan trọng để xác định an toàn, khả năng chịu đựng, và liệu các lợi thế tiền lâm sàng có chuyển thành các phản ứng lâm sàng bền vững cho bệnh nhân mắc bệnh bạch huyết tế bào tương tái phát/kháng trị.
Hỗ trợ và ClinicalTrials.gov
Nghiên cứu được thực hiện bởi các nhà nghiên cứu liên kết với tổ chức phát triển và được hỗ trợ bởi nguồn lực của công ty như được báo cáo trong bản thảo gốc. Thử nghiệm lâm sàng đăng ký để đánh giá ramantamig trong bệnh bạch huyết tế bào tương tái phát/kháng trị: NCT05652335 và NCT06768489.
Tham khảo
Pillarisetti K, Yang D, Luistro L, Yao J, Smith M, Vulfson P, Testa J Jr, Ponticiello R, Brodeur SR, Heidrich B, Packman K, Singh S, Attar RM, Elsayed YA, Philippar U. Ramantamig (JNJ-79635322), a novel T-cell-engaging trispecific antibody targeting BCMA, GPRC5D, and CD3, in multiple myeloma models. Blood. 2025 Oct 16:blood.2025030027. doi: 10.1182/blood.2025030027. Epub ahead of print. PMID: 41100731.