Nhấn mạnh
- Chuyển đổi từ liệu pháp chất ức chế nucleo(s)tide (NUC) sang interferon alpha-2a kết hợp polyethylene glycol (PegIFN-α-2a) giảm đáng kể nguy cơ tái phát vi-rút ở bệnh nhân viêm gan B mạn tính không HBeAg.
- Bệnh nhân nhận PegIFN-α-2a có tỷ lệ mất kháng nguyên bề mặt HBs (HBsAg) cao hơn so với những người chỉ ngừng dùng NUC.
- Nghiên cứu này cung cấp một chiến lược điều trị tối ưu để quản lý việc ngừng dùng NUC, giảm nguy cơ tái phát và cải thiện kiểm soát vi-rút lâu dài.
Nền tảng Nghiên cứu và Gánh nặng Bệnh tật
Viêm gan B mạn tính do vi-rút (HBV) vẫn là thách thức sức khỏe cộng đồng toàn cầu, gây ra tỷ lệ mắc và tử vong đáng kể do xơ gan và ung thư gan. Quản lý chống vi-rút hiện tại chủ yếu bao gồm việc điều trị kéo dài bằng chất ức chế nucleo(s)tide (NUCs), hiệu quả trong việc ức chế sự sao chép của HBV. Tuy nhiên, kiểm soát vi-rút kéo dài thường yêu cầu điều trị vô thời hạn vì việc ngừng điều trị có thể dẫn đến tỷ lệ tái phát vi-rút cao và các đợt bùng phát lâm sàng, đặc biệt là ở bệnh nhân không HBeAg. Những đợt tái phát này mang lại rủi ro bao gồm suy gan và làm suy yếu nỗ lực hướng tới sự chữa khỏi chức năng, được đặc trưng bởi mất kháng nguyên bề mặt HBs (HBsAg).
Interferon alpha-2a kết hợp polyethylene glycol (PegIFN-α-2a), với cơ chế chống vi-rút và miễn dịch kép, là một liệu pháp thay thế có tiềm năng tăng tỷ lệ mất HBsAg. Tuy nhiên, vai trò của nó như một liệu pháp củng cố sau khi ngừng dùng NUC, đặc biệt là để giảm nguy cơ tái phát và thúc đẩy sự thanh thải vi-rút ở bệnh nhân không HBeAg, vẫn chưa rõ ràng. Nhu cầu lâm sàng chưa được đáp ứng này đã thúc đẩy thử nghiệm đối chứng ngẫu nhiên (NCT02594293) được thảo luận ở đây, tập trung vào việc đánh giá liệu việc chuyển bệnh nhân từ liệu pháp NUC kéo dài sang PegIFN-α-2a trong 48 tuần có thể tối ưu hóa kết quả sau khi ngừng điều trị hay không.
Thiết kế Nghiên cứu
Thử nghiệm lâm sàng đối chứng ngẫu nhiên đa trung tâm này đã tuyển dụng 180 bệnh nhân không xơ gan có viêm gan B mạn tính không HBeAg đã được điều trị liên tục bằng NUC ít nhất 2,5 năm với HBV DNA không phát hiện hoặc rất thấp (<60 IU/mL). Bệnh nhân được phân ngẫu nhiên 1:1 thành hai nhóm:
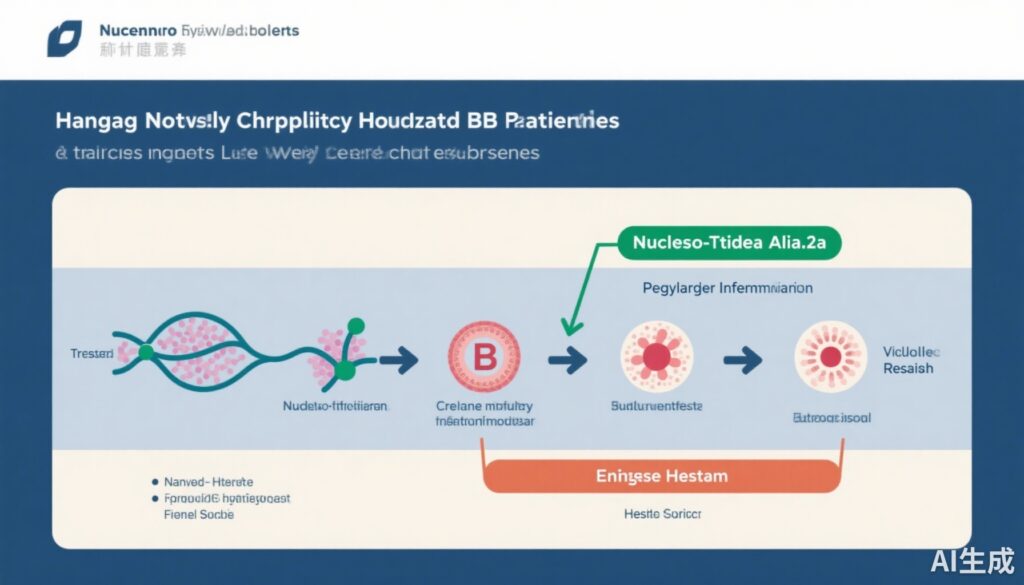
1. Nhóm Ngừng Dùng NUC (n=90): Bệnh nhân ngừng dùng NUC mà không có can thiệp chống vi-rút khác.
2. Nhóm Liệu pháp Độc lập PegIFN-α-2a (n=90): Bệnh nhân ngừng dùng NUC và chuyển ngay sang PegIFN-α-2a trong 48 tuần.
Điểm cuối chính là tỷ lệ tái phát vi-rút tích lũy, được xác định bằng sự xuất hiện trở lại của HBV DNA trên các ngưỡng đã quy định, đo lường lên đến 96 tuần từ cơ sở. Bệnh nhân được theo dõi chặt chẽ về các dấu hiệu vi-rút, lâm sàng và huyết thanh học, bao gồm mức độ HBsAg và các chỉ số tái phát lâm sàng.
Kết quả Chính
Phân tích theo ý định điều trị cho thấy tác động đáng kể của PegIFN-α-2a trong việc giảm nguy cơ tái phát:
– Tỷ lệ Tái phát Vi-rút Tích lũy tại Tuần 96: 20,8% ở nhóm PegIFN-α-2a so với 53,6% ở nhóm ngừng dùng NUC (p <0,0001).
– Tại 48 tuần sau khi ngừng điều trị, nhóm PegIFN-α-2a duy trì tỷ lệ tái phát thấp hơn đáng kể (17,8% so với 36,7%; p = 0,007).
– Tỷ lệ tái phát lâm sàng, bao gồm các đợt bùng phát ALT và dấu hiệu tổn thương gan, thấp hơn ở nhóm PegIFN-α-2a (7,8% so với 20,9%; p = 0,008).
– Tỷ lệ mất HBsAg, dấu hiệu của sự chữa khỏi chức năng, cao hơn đáng kể ở nhóm PegIFN-α-2a (21,5% so với 9,0%; p = 0,03).
Phân tích tương quan cho thấy mối liên hệ tích cực giữa lượng hóa HBsAg cơ bản và khả năng tái phát vi-rút ở bệnh nhân ngừng dùng NUC mà không tiếp tục dùng PegIFN. Điều này hỗ trợ vai trò của lượng hóa HBsAg như một dấu hiệu sinh học dự đoán nguy cơ tái phát.
Dữ liệu về an toàn và khả năng dung nạp, mặc dù không được nêu chi tiết trong bản tóm tắt này, là những cân nhắc thiết yếu, đặc biệt là do liệu pháp interferon được biết đến với các tác dụng phụ như triệu chứng giống cảm cúm và giảm tiểu cầu. Thiết lập kiểm soát và thời gian theo dõi của nghiên cứu đã thiết lập một hồ sơ lợi ích-nguy cơ có ý nghĩa lâm sàng cho chiến lược chuyển đổi sang PegIFN.
Bình luận Chuyên gia
Thử nghiệm đối chứng ngẫu nhiên nghiêm ngặt này của Li et al. giải quyết một vấn đề lâm sàng quan trọng trong quản lý viêm gan B mạn tính không HBeAg: làm thế nào để an toàn ngừng điều trị NUC kéo dài trong khi tối thiểu hóa nguy cơ tái phát và tối đa hóa cơ hội mất HBsAg. Bằng chứng cho thấy liệu pháp PegIFN-α-2a trong 48 tuần sau khi ngừng dùng NUC giảm đáng kể tỷ lệ tái phát vi-rút và tăng gấp đôi tỷ lệ mất HBsAg là thuyết phục.
Khả năng sinh học nằm ở tác dụng miễn dịch của PegIFN-α-2a, tăng cường khả năng miễn dịch chống vi-rút của cơ thể và có thể thúc đẩy im lặng của cccDNA, bổ sung cho sự ức chế vi-rút đạt được bằng NUCs. Cách tiếp cận tích hợp này trái ngược với việc ngừng đột ngột NUC, có thể dẫn đến sự bùng phát vi-rút không kiểm soát.
Mặc dù hứa hẹn, các cân nhắc bao gồm việc cần xác định các ứng viên lý tưởng cho việc chuyển đổi sang PegIFN—bệnh nhân có mức HBsAg cơ bản thấp dường như có lợi nhất. Ngoài ra, các tác dụng phụ và chống chỉ định của PegIFN phải được cân nhắc kỹ lưỡng trong các quyết định lâm sàng. Các nghiên cứu trong tương lai có thể khám phá các thuật toán điều trị dựa trên dấu hiệu sinh học, tính bền vững lâu dài của việc mất HBsAg và các kết quả về chất lượng cuộc sống.
Kết luận
Thử nghiệm đối chứng ngẫu nhiên mang tính bước ngoặt này chứng minh rằng việc chuyển từ liệu pháp chất ức chế nucleo(s)tide kéo dài sang liệu pháp interferon alpha-2a kết hợp polyethylene glycol (PegIFN-α-2a) có định mức giảm đáng kể nguy cơ tái phát vi-rút và tăng cường tỷ lệ chữa khỏi chức năng ở bệnh nhân viêm gan B mạn tính không HBeAg. Chiến lược thực tế này giải quyết một thách thức lớn trong quản lý HBV—ngừng điều trị an toàn—và thúc đẩy tiến trình hướng tới kiểm soát vi-rút cuối cùng.
Bác sĩ lâm sàng nên cân nhắc tích hợp PegIFN-α-2a như một liệu pháp củng cố khi cân nhắc ngừng sử dụng NUC, đặc biệt là ở bệnh nhân không xơ gan và mức HBV DNA thấp. Nghiên cứu đang diễn ra sẽ tinh chỉnh việc lựa chọn bệnh nhân và tối ưu hóa các giao thức để tối đa hóa lợi ích trong khi giảm thiểu rủi ro.
Tài liệu tham khảo
1. Li F, Qu L, Liu Y, et al. PegIFN alpha-2a reduces relapse in HBeAg-negative patients after nucleo(s)tide analogue cessation: A randomized-controlled trial. J Hepatol. 2025 Feb;82(2):211-221. doi: 10.1016/j.jhep.2024.07.019.
2. European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2017 Aug;67(2):370-398.
3. Terrault NA, Lok ASF, McMahon BJ, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 Hepatitis B Guidance. Hepatology. 2018 Apr;67(4):1560-1599.