Nhấn mạnh
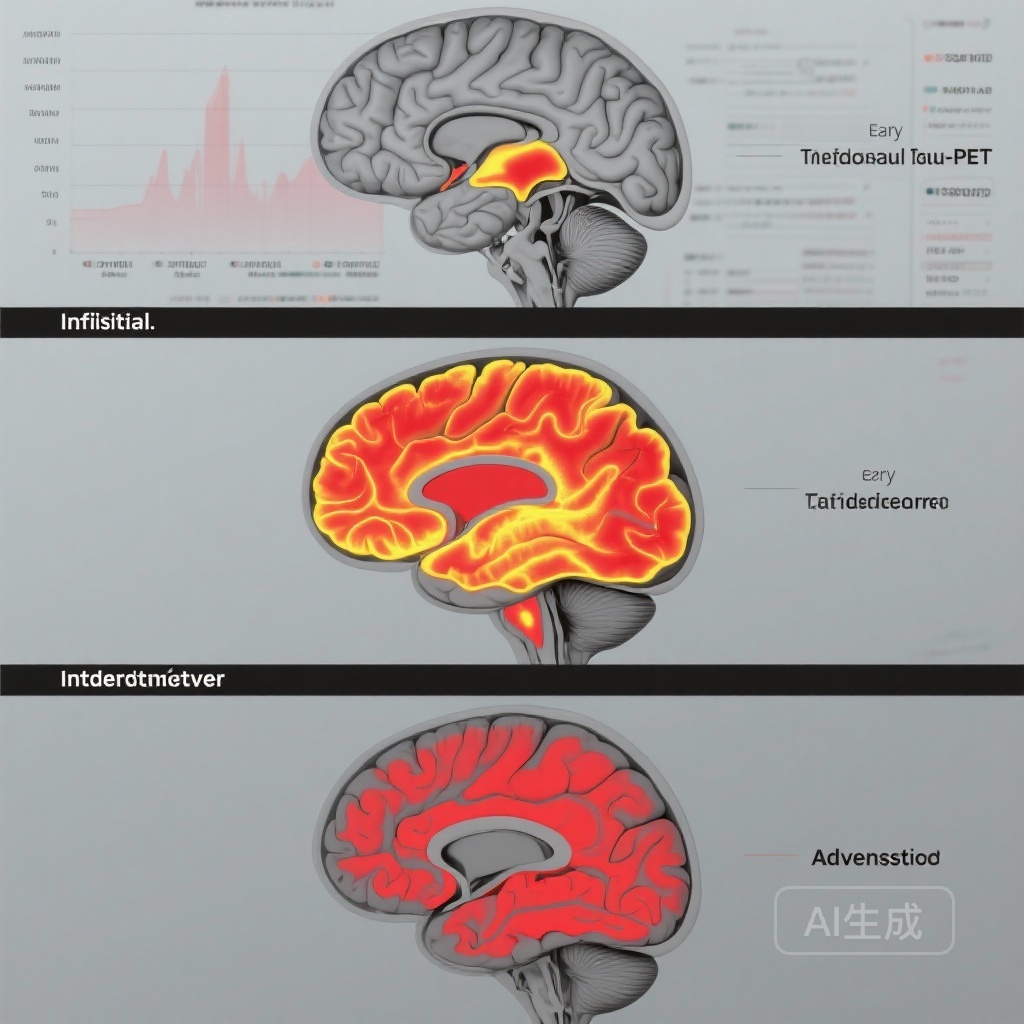
– Sự tích tụ tau-PET theo thời gian phụ thuộc vào giai đoạn: thay đổi tối thiểu ở giai đoạn A+T2- (ban đầu), tăng trưởng cục bộ ở giai đoạn sớm, và tích tụ rộng rãi hơn ở giai đoạn trung gian và tiến triển.
– Giai đoạn sinh học Alzheimer cơ bản (A+/T) dự đoán cả phân bố khu vực và mức độ tăng trưởng của sự lan truyền tau sau đó ở hai nhóm độc lập (TRIAD và ADNI).
– Việc chọn vùng quan tâm (ROI) kết quả phù hợp với giai đoạn bệnh đã giảm ước tính kích thước mẫu thử nghiệm từ 30%–93% cho các hiệu ứng điều chỉnh bệnh giả định.
Nền tảng
Bệnh Alzheimer (AD) ngày càng được hiểu là một chuỗi sinh học được xác định bởi các dấu hiệu sinh học in vivo của amyloid-β (A) và tau (T) cũng như sự thoái hóa thần kinh (N) thay vì chỉ dựa vào các triệu chứng lâm sàng. Khung nghiên cứu NIA-AA đã chính thức hóa cách tiếp cận này, cho phép các thử nghiệm tuyển chọn và phân loại người tham gia dựa trên giai đoạn bệnh được xác định bằng dấu hiệu sinh học và chọn kết quả dấu hiệu sinh học phản ánh sinh học mục tiêu và bệnh lý theo giai đoạn (Jack et al., 2018). Hiện nay, tomography phát xạ positron tau (tau-PET) được sử dụng rộng rãi để phân loại bệnh sinh học và là kết quả dược động học tiềm năng cho các can thiệp chống tau hoặc chống amyloid. Tuy nhiên, các mô hình tích tụ tau-PET theo thời gian qua các giai đoạn sinh học của AD — và cách các mô hình này nên hướng dẫn việc chọn ROI và lập kế hoạch kích thước mẫu cho các thử nghiệm — chưa được lượng hóa đầy đủ trong các nhóm lớn, được xác định rõ ràng.
Thiết kế nghiên cứu
Trudel và đồng nghiệp đã thực hiện phân tích theo thời gian hồi cứu đối với người tham gia từ hai nhóm quan sát: nghiên cứu Translational Biomarkers in Aging and Dementia (TRIAD) và Alzheimer’s Disease Neuroimaging Initiative (ADNI). Người tham gia đã trải qua chụp ảnh amyloid-PET và tau-PET cơ bản và được theo dõi theo thời gian trung bình khoảng 3 năm (±1.35 năm). Phân loại sinh học AD được áp dụng cho những người dương tính với amyloid bằng cách sử dụng phân loại dựa trên tau-PET: A+T2- (ban đầu), A+T2MTL+ (sớm; tau ở thùy thái dương giữa), A+T2MOD+ (trung gian; sự tham gia rộng rãi hơn ở thùy thái dương và parietal), và A+T2HIGH+ (tiến triển; sự tham gia rộng rãi ở vỏ não mới). Những người âm tính với amyloid-PET được sử dụng làm nhóm kiểm soát không mắc AD. Phân tích chính sử dụng các mô hình hiệu ứng hỗn hợp tuyến tính để ước tính sự thay đổi tau-PET theo thời gian theo khu vực và giai đoạn. Các phân tích phụ bao gồm mô phỏng sức mạnh thống kê và kích thước mẫu để ước tính số người tham gia cần thiết để phát hiện các hiệu ứng điều chỉnh bệnh giả định trên sự tích tụ tau khi ROI được căn chỉnh hoặc không căn chỉnh với giai đoạn cơ bản.
Kết quả chính
Dân số: Phân tích tổng hợp bao gồm 542 người tham gia (tuổi trung bình 67.9 ± 15.3 năm, 56.3% nữ), với 321 người kiểm soát không mắc AD và 221 trường hợp AD được xác định bằng dấu hiệu sinh học.
Giai đoạn quyết định cả phân bố và tốc độ tích tụ tau
Kết quả chính là giai đoạn tau cơ bản dự đoán cả nơi và tốc độ tăng tín hiệu tau-PET theo thời gian. Cụ thể:
- Không có sự tích tụ tau có ý nghĩa theo thời gian nào được quan sát trong 4–6 năm ở người A+T2- (ban đầu), chỉ ra một giai đoạn kéo dài trước khi sự lây lan tau có thể đo được bằng PET ra khỏi mức ngưỡng dưới trong những người dương tính với amyloid nhưng âm tính với tau.
- Người tham gia ở giai đoạn sớm (A+T2MTL+) thể hiện sự tích tụ tau cục bộ giới hạn ở các khu vực bị ảnh hưởng sớm (TRIAD: β = 0.15, 95% CI 0.09–0.21, p < 0.001; ADNI: β = 0.21, 95% CI 0.03–0.40, p = 0.03), nhất quán với sự tham gia tiến triển của các cấu trúc vòm và thái dương giữa.
- Người tham gia ở giai đoạn trung gian (A+T2MOD+) thể hiện sự tích tụ ở các khu vực phân bố trung gian (TRIAD: β = 0.16, 95% CI 0.10–0.22, p < 0.001; ADNI: β = 0.37, 95% CI 0.15–0.59, p = 0.001), chỉ ra sự lan truyền vượt quá các thùy thái dương giữa đến các thùy thái dương và parietal.
- Người tham gia ở giai đoạn tiến triển (A+T2HIGH+) thể hiện sự tăng lớn và rộng rãi nhất ở các khu vực vỏ não mới bị ảnh hưởng sau (TRIAD: β = 0.45, 95% CI 0.39–0.50, p < 0.001; ADNI: β = 0.31, 95% CI 0.14–0.49, p < 0.001).
Ý nghĩa đối với việc chọn ROI và hiệu quả thử nghiệm
Mô phỏng sức mạnh thống kê cho thấy việc chọn ROI tau-PET phù hợp với giai đoạn (tức là tập trung vào các khu vực dự kiến sẽ tích tụ tau dựa trên giai đoạn cơ bản) đã làm giảm đáng kể kích thước mẫu ước tính cần thiết để phát hiện một hiệu ứng điều chỉnh bệnh giả định trên sự tiến triển của tau. Các mức giảm được báo cáo dao động từ 30% đến 93% tùy thuộc vào giai đoạn và nhóm. Những lợi ích lớn nhất xảy ra khi sử dụng ROI ở giai đoạn tiến triển trong dân số đã thể hiện sự tích tụ tau rộng rãi — một bối cảnh mà cả tín hiệu cơ bản và phạm vi động đều lớn nhất.
Tính tái tạo qua các nhóm
Các kết quả nhất quán qua các nhóm độc lập TRIAD và ADNI mặc dù có sự khác biệt về chất đánh dấu, quy trình thu thập dữ liệu và nhân khẩu học của người tham gia, hỗ trợ khả năng tổng quát hóa của động lực học tau phụ thuộc vào giai đoạn. Tuy nhiên, các tác giả lưu ý rằng sự đa dạng về chất đánh dấu và thành phần nhóm vẫn là những hạn chế chính đối với sự hài hòa giữa các nghiên cứu.
Bình luận chuyên gia
Các kết quả này xác nhận một nguyên tắc thực tế cho các thử nghiệm AD: căn chỉnh việc tuyển chọn người tham gia và đo lường kết quả với sinh học hiện hành. Đối với các liệu pháp nhắm mục tiêu tau, việc tuyển chọn người tham gia có giai đoạn tau phù hợp là quan trọng. Ở giai đoạn sớm hoặc tiền-tau (A+T2-), các thử nghiệm dựa trên sự thay đổi tau-PET làm kết quả chính có thể bị thiếu sức mạnh vì ít hoặc không có sự thay đổi có thể đo được bằng PET trong vài năm. Ngược lại, người tham gia ở giai đoạn trung gian hoặc tiến triển cung cấp sự thay đổi có thể đo lường theo thời gian và tín hiệu thống kê lớn hơn, nhưng họ có thể ít đáp ứng hơn đối với các can thiệp điều chỉnh bệnh nếu thoái hóa thần kinh xuống dòng đã được thiết lập.
Từ góc độ cơ chế, sự lan truyền tau phụ thuộc vào giai đoạn được quan sát ở đây phản ánh phân loại bệnh lý thần kinh Braak, nơi bệnh lý tau bắt đầu ở vỏ não transentorhinal/entorhinal trước khi lan truyền đến các vùng vòm và vỏ não (Braak & Braak, 1991). Phân loại dựa trên PET vận hành hóa chuỗi bệnh lý thần kinh này in vivo, cho phép thiết kế thử nghiệm có mục tiêu.
Hạn chế cần xem xét: nghiên cứu này là hồi cứu và quan sát, do đó không thể đưa ra các suy luận nhân quả về việc điều chỉnh liệu pháp. Sự khác biệt về chất đánh dấu PET, xử lý hình ảnh, thành phần nhân khẩu học và thời gian theo dõi giữa các nhóm có thể gây ra sự đa dạng trong ước lượng hiệu ứng. Cuối cùng, việc lượng hóa tau-PET có các vấn đề kỹ thuật (gắn kết không mục tiêu cho một số chất đánh dấu, hiệu ứng thể tích phần) có thể ảnh hưởng đến độ nhạy đối với sự thay đổi.
Ý nghĩa lâm sàng và thiết kế thử nghiệm
Đối với các nhà tài trợ và nhà nghiên cứu lên kế hoạch cho các thử nghiệm điều chỉnh bệnh, các điểm cần lưu ý thực tế bao gồm:
- Sử dụng phân loại dấu hiệu sinh học (khung A/T) trong quá trình sàng lọc để đảm bảo rằng người tham gia đã đăng ký có mức độ tau và phạm vi động dự kiến phù hợp với kết quả được chọn. Tránh dựa vào tau-PET làm kết quả theo thời gian ở dân số A+T2- trừ khi kích thước hiệu ứng mong đợi lớn hoặc thời gian theo dõi rất dài.
- Chọn ROI(s) phù hợp với giai đoạn cơ bản (ví dụ, ROI thái dương giữa cho người tham gia ở giai đoạn sớm, ROI thái dương-parietal hoặc toàn cầu vỏ não cho giai đoạn trung gian/tiến triển) để tối đa hóa sức mạnh và giảm kích thước mẫu và chi phí.
- Xem xét kết hợp các kết quả dấu hiệu sinh học (tau-PET cộng với các dấu hiệu lỏng hoặc MRI cấu trúc) khi nhắm mục tiêu giai đoạn sớm để bắt được các tín hiệu bổ sung có thể thay đổi trước khi sự tích tụ tau có thể đo được bằng PET.
- Đưa ra các giao thức hình ảnh hài hòa và sử dụng chất đánh dấu có thể ở các địa điểm nếu có thể để giảm sự đa dạng trong đo lường; khi cần sử dụng nhiều chất đánh dấu, áp dụng các phương pháp chuẩn hóa chéo chất đánh dấu đã được xác minh.
Kết luận
Trudel et al. cung cấp bằng chứng theo thời gian mạnh mẽ rằng sự tích tụ tau-PET phụ thuộc mạnh vào giai đoạn trong AD được xác định sinh học. Giai đoạn A/T cơ bản dự đoán cả các mô hình khu vực và tốc độ tăng trưởng của sự lan truyền tau sau đó, và việc căn chỉnh ROI kết quả với giai đoạn bệnh có thể cải thiện đáng kể hiệu quả thử nghiệm. Các kết quả này lập luận cho việc áp dụng thường xuyên phân loại sinh học trong quá trình sàng lọc thử nghiệm và việc chọn điểm cuối hình ảnh phù hợp với giai đoạn một cách cẩn thận trong quá trình phát triển liệu pháp AD.
Kinh phí và clinicaltrials.gov
Chi tiết kinh phí chính và hỗ trợ cụ thể cho từng nhóm được báo cáo trong bài viết gốc (Trudel et al., Neurology 2025). ADNI là một đối tác công-tư được hỗ trợ bởi nhiều khoản tài trợ NIH và các nhà đóng góp ngành công nghiệp; TRIAD nhận được hỗ trợ tổ chức và tài trợ như được mô tả trong tài liệu nhóm. Không có số hiệu clinicaltrials.gov áp dụng cho phân tích quan sát hồi cứu này.
Tài liệu tham khảo
Trudel L, Therriault J, Macedo AC, Servaes S, Hosseini SA, Bezgin G, Aumont E, Rahmouni N, Fernandez Arias J, Zheng Y, Wang YT, Chan T, Hall BJ, Hopewell R, Hsiao CH, Ferreira PCL, Bellaver B, Vitali P, Soucy JP, Pascoal TA, Gauthier S, Rosa-Neto P; Alzheimer’s Disease Neuroimaging Initiative. Implication for Clinical Trials From Longitudinal Tau-PET Accumulation Across Biological Alzheimer Disease Stages. Neurology. 2025 Oct 21;105(8):e214111. doi: 10.1212/WNL.0000000000214111. PMID: 40986433; PMCID: PMC12459282.
Jack CR Jr, Bennett DA, Blennow K, Carrillo MC, Dunn B, Haeberlein SB, Holtzman DM, Jagust W, Jessen F, Karlawish J, et al. NIA-AA Research Framework: Toward a biological definition of Alzheimer’s disease. Alzheimers Dement. 2018 Apr;14(4):535-562. doi: 10.1016/j.jalz.2018.02.018.
Braak H, Braak E. Neuropathological stageing of Alzheimer-related changes. Acta Neuropathol. 1991;82(4):239–259. doi:10.1007/BF00308809.