Tổng quan
- IBI311, một chất ức chế IGF-1R tương tự như teprotumumab, đã thể hiện tỷ lệ đáp ứng lồi mắt 85.8% sau 24 tuần ở bệnh nhân Trung Quốc mắc bệnh mắt bướm (TED) mức độ trung bình đến nặng, so với 3.8% ở nhóm đối chứng.
- Thử nghiệm cho thấy giảm đáng kể điểm số hoạt động lâm sàng (CAS) và lồi mắt, xác nhận lợi ích chống viêm và cấu trúc giải phẫu trong TED hoạt động.
- IBI311 có hồ sơ an toàn tốt, chỉ có các tác dụng phụ nhẹ đến trung bình và không có tác dụng phụ nghiêm trọng nào được báo cáo.
Nền tảng nghiên cứu
Bệnh mắt bướm (TED) là một rối loạn viêm tự miễn chủ yếu ảnh hưởng đến vùng quỹ đạo và mô quanh quỹ đạo, thường liên quan đến bệnh Graves. Nó biểu hiện lâm sàng bằng lồi mắt, co rút mi mắt, đôi mắt, và viêm nhiễm, có thể dẫn đến biến dạng nghiêm trọng, suy giảm thị lực và giảm chất lượng cuộc sống. TED có sự biến đổi về hình thái học giữa các chủng tộc, ảnh hưởng đến mức độ nghiêm trọng của bệnh và phản ứng với điều trị. Dù có những tiến bộ, các lựa chọn điều trị vẫn còn hạn chế, đặc biệt là đối với TED hoạt động mức độ trung bình đến nặng.
Các tiến bộ gần đây đã xác định con đường tín hiệu insulin-like growth factor 1 receptor (IGF-1R) là trung tâm trong cơ chế gây bệnh của TED. Teprotumumab, một kháng thể đơn dòng người nhắm vào IGF-1R, đã được FDA phê duyệt năm 2020 dựa trên các thử nghiệm then chốt chủ yếu ở dân số không phải người Á. Tuy nhiên, khả năng tiếp cận thực tế với loại điều trị này ở châu Á bị hạn chế, và dữ liệu về hiệu quả và an toàn ở dân số Á, đặc biệt là Trung Quốc, rất ít. IBI311 là một chất ức chế IGF-1R có chuỗi axit amin giống hệt teprotumumab nhưng khác biệt về dạng bào chế, được phát triển để sử dụng cho bệnh nhân Trung Quốc.
Thiết kế nghiên cứu
RESTORE-1 là một thử nghiệm lâm sàng giai đoạn 3 đa trung tâm, ngẫu nhiên, mù đôi, đối chứng giả dược được thực hiện từ tháng 5 đến tháng 12 năm 2023 tại 20 bệnh viện hạng ba ở Trung Quốc. Tám mươi hai người tham gia mắc TED hoạt động mức độ trung bình đến nặng (định nghĩa bởi điểm số hoạt động lâm sàng [CAS] ≥3) đã được đăng ký. Các tiêu chí loại trừ chính bao gồm khởi phát TED hơn 270 ngày, TED đe dọa thị lực, và điều trị trước đó bằng corticosteroid tiêm tĩnh mạch, xạ trị, hoặc phẫu thuật quỹ đạo.
Người tham gia được ngẫu nhiên hóa theo tỷ lệ 2:1 để nhận truyền tĩnh mạch IBI311 hoặc giả dược mỗi ba tuần trong 21 tuần, với đánh giá tiếp tục đến tuần 24. Điểm cuối chính là tỷ lệ người tham gia đạt giảm lồi mắt ≥2 mm ở mắt nghiên cứu tại tuần 24.
Điểm cuối phụ bao gồm đáp ứng tổng hợp (giảm lồi mắt và CAS), cải thiện CAS, đáp ứng đôi mắt, và đánh giá an toàn tập trung vào các tác dụng phụ đã biết liên quan đến ức chế IGF-1R.
Kết quả chính
Trong 82 người tham gia được ngẫu nhiên hóa (tuổi trung bình 39.6 tuổi; 68.3% nữ), 54 người nhận IBI311 và 28 người nhận giả dược. Kết quả tại tuần 24 rất ấn tượng:
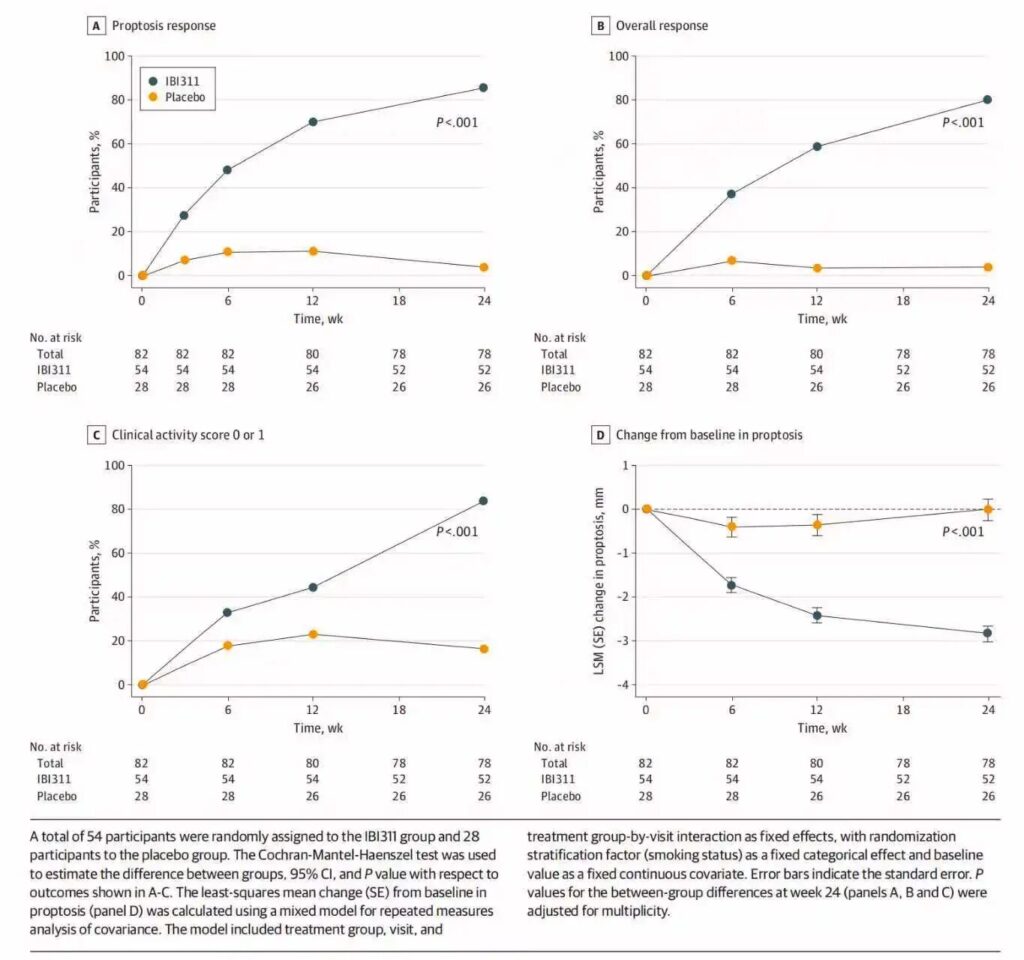
- Đáp ứng lồi mắt: 85.8% (45/52) ở nhóm IBI311 so với 3.8% (1/26) ở nhóm giả dược (sự chênh lệch 81.9 điểm phần trăm; khoảng tin cậy 95%, 69.8 đến 93.9; P < .001).
- Đáp ứng tổng hợp: Giảm lồi mắt ≥2 mm và giảm CAS ≥2 xảy ra ở 80.2% người nhận IBI311 so với 3.6% ở giả dược (sự chênh lệch 76.3 điểm phần trăm; khoảng tin cậy 95%, 63.3 đến 89.4).
- Cải thiện CAS: Đạt điểm CAS 0 hoặc 1 ở 83.5% so với 16.6% (sự chênh lệch 67.1 điểm phần trăm; khoảng tin cậy 95%, 49.4 đến 84.8).
- Mức độ lồi mắt: Thay đổi trung bình theo phương pháp bình phương tối thiểu là -2.85 mm (SE 0.18) với IBI311 so với -0.02 mm (SE 0.24) với giả dược (sự chênh lệch -2.83 mm; khoảng tin cậy 95%, -3.39 đến -2.27; tất cả P < .001).
- Đáp ứng đôi mắt: Giảm ít nhất một cấp độ được ghi nhận ở 66.0% bệnh nhân IBI311 so với 53.3% giả dược, nhưng sự chênh lệch này không có ý nghĩa thống kê (P = .46).
Phân tích an toàn cho thấy tất cả các tác dụng phụ liên quan đến phản ứng truyền dịch, suy giảm thính lực, tăng đường huyết, co thắt cơ, buồn nôn, hoặc tiêu chảy đều nhẹ hoặc trung bình. Không có tác dụng phụ nghiêm trọng hoặc tử vong nào xảy ra ở nhóm IBI311.
Bình luận chuyên gia
Thử nghiệm RESTORE-1 khẳng định mạnh mẽ rằng nhắm mục tiêu IGF-1R bằng IBI311 mang lại cải thiện có ý nghĩa lâm sàng cho bệnh nhân Trung Quốc mắc TED hoạt động, một nhóm trước đây chưa được nghiên cứu đầy đủ. Mức độ giảm lồi mắt (-2.85 mm) và cải thiện CAS tương đương với các thử nghiệm then chốt của teprotumumab, củng cố vai trò cơ chế của con đường IGF-1R trong TED.
Quan trọng, nghiên cứu này giải quyết khoảng cách về chủng tộc và địa lý trong nghiên cứu lâm sàng TED. Do sự biến đổi hình thái học và các khác biệt dược lý gen có thể ảnh hưởng đến hiệu quả và an toàn, kết quả tích cực trong nhóm bệnh nhân Trung Quốc hỗ trợ IBI311 là một lựa chọn điều trị phù hợp về văn hóa và khu vực.
Tuy nhiên, một số hạn chế cần lưu ý. Nghiên cứu đã loại trừ bệnh nhân mắc bệnh đe dọa thị lực và những người mắc TED kéo dài (>270 ngày), vì vậy kết quả có thể không áp dụng cho tất cả các dân số TED. Dữ liệu dài hạn về tính bền vững của đáp ứng và hiệu quả thực tế cũng đang chờ đợi. Ngoài ra, kết quả về đôi mắt kém chắc chắn hơn, gợi ý rằng hiệu quả điều trị cho rối loạn vận động có thể thay đổi nhiều hơn.
Kết luận
IBI311 đã thể hiện hiệu quả đáng kể và hồ sơ an toàn đáng tin cậy trong việc điều trị TED hoạt động mức độ trung bình đến nặng ở bệnh nhân Trung Quốc. Sự tương đương về chuỗi axit amin với teprotumumab nhưng dạng bào chế khác biệt cho phép mở rộng khả năng tiếp cận trong khi duy trì lợi ích điều trị. Các bác sĩ nên cân nhắc IBI311 là một lựa chọn hứa hẹn để giải quyết nhu cầu chưa được đáp ứng trong dân số TED Á.
Nghiên cứu trong tương lai sẽ có giá trị để đánh giá kết quả dài hạn, ứng dụng thực tế, và sử dụng trong các nhóm con đa dạng. Tổng thể, IBI311 đại diện cho một bước tiến đáng kể trong quản lý TED, cải thiện kết quả bệnh nhân và mở rộng các lựa chọn điều trị toàn cầu.
Quỹ tài trợ và Đăng ký Thử nghiệm
Thử nghiệm này đã được đăng ký tại ClinicalTrials.gov với mã định danh NCT05795621. Các nguồn tài trợ không được báo cáo rõ ràng trong bản công bố chính.
Tài liệu tham khảo
Zhang H, Sun J, Li Y, Zhu L, Shan Z, Lu W, et al. IGF-1R Inhibitor IBI311 for the Treatment of Active Thyroid Eye Disease in Chinese Patients: The RESTORE-1 Randomized Clinical Trial. JAMA Ophthalmol. 2025 Oct 9:e253350. doi:10.1001/jamaophthalmol.2025.3350 . Epub ahead of print. PMID: 41066129 ; PMCID: PMC12512031 .
Các tài liệu tham khảo bổ sung về TED và con đường IGF-1R có sẵn trong các tài liệu nội tiết học và nhãn khoa tiêu chuẩn.