Những điểm chính
- Giải thích định nghĩa và ý nghĩa lâm sàng của các điểm cuối chính trong các thử nghiệm ung thư: OS, DFS, PFS, ORR, CR, PR, SD, PD và DCR.
- Cung cấp hướng dẫn thực tế để diễn giải các điểm cuối này trong cả thực hành lâm sàng và nghiên cứu.
- Thảo luận về ưu điểm, hạn chế và ứng dụng phù hợp của mỗi điểm cuối trong các thiết kế thử nghiệm khác nhau.
Nền tảng và bối cảnh lâm sàng
Các thử nghiệm lâm sàng về ung thư dựa trên các điểm cuối được xác định rõ ràng để đo lường hiệu quả của các liệu pháp mới. Khi các liệu pháp ung thư trở nên đa dạng và cá nhân hóa hơn, việc hiểu các điểm cuối này đã trở nên thiết yếu đối với các bác sĩ, nhà nghiên cứu và cơ quan quản lý. Các điểm cuối như Tổng thời gian sống (OS), Thời gian sống không bệnh (DFS), Thời gian sống không tiến triển (PFS), Tỷ lệ đáp ứng khách quan (ORR), Đáp ứng hoàn toàn (CR), Đáp ứng部分 (PR), Bệnh ổn định (SD), Bệnh tiến triển (PD) và Tỷ lệ kiểm soát bệnh (DCR) nay đã trở thành trung tâm trong việc đánh giá lợi ích lâm sàng, phê duyệt quy định và hướng dẫn bệnh nhân.
Gánh nặng ung thư toàn cầu ngày càng tăng nhấn mạnh nhu cầu có các điểm cuối nghiêm ngặt và có thể diễn giải. Theo GLOBOCAN 2020, ung thư là nguyên nhân hàng đầu gây ra bệnh tật và tử vong trên toàn thế giới, đòi hỏi các chỉ số hiệu quả chính xác cho các loại thuốc mới để đảm bảo tác động lâm sàng có ý nghĩa [1].
Xem xét thiết kế nghiên cứu: Các điểm cuối trong các thử nghiệm ung thư
Các thử nghiệm ung thư thường là các thử nghiệm đối chứng ngẫu nhiên (RCTs) hoặc các nghiên cứu đơn tay, mỗi loại có chiến lược điểm cuối riêng biệt. Sự lựa chọn điểm cuối phụ thuộc vào giai đoạn bệnh, kết quả mong đợi, quần thể bệnh nhân và hướng dẫn quy định. Hướng dẫn về “Thiết kế thống kê của các thử nghiệm lâm sàng thuốc chống khối u” của Trung tâm Đánh giá Dược phẩm Trung Quốc phản ánh các tiêu chuẩn quốc tế như của Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) và Cơ quan Dược phẩm châu Âu (EMA).
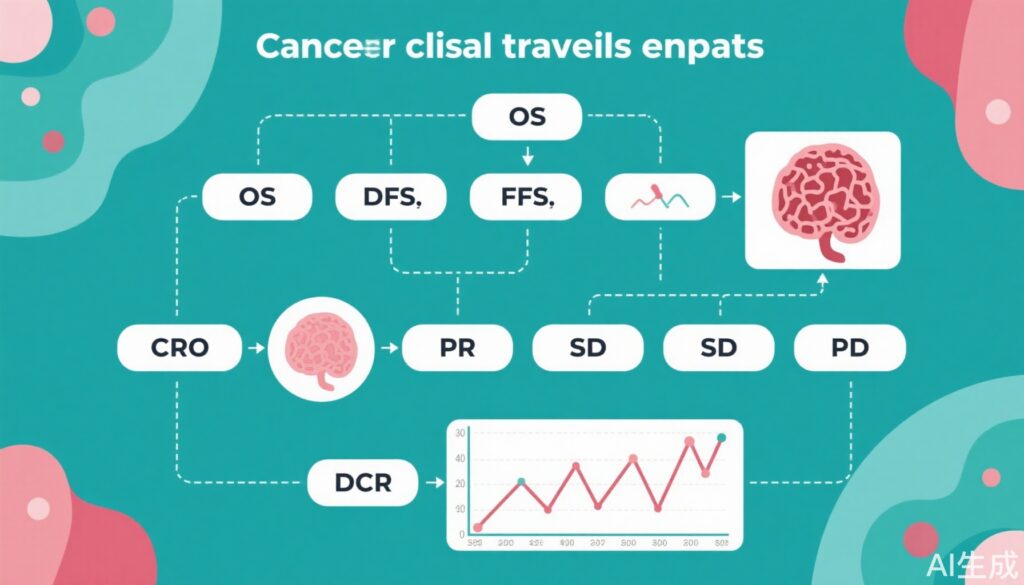
– OS (Tổng thời gian sống): Được định nghĩa là thời gian từ khi phân ngẫu nhiên (hoặc bắt đầu điều trị trong các nghiên cứu đơn tay) đến khi tử vong do bất kỳ nguyên nhân nào.
– DFS (Thời gian sống không bệnh): Thời gian từ khi phân ngẫu nhiên đến khi tái phát bệnh hoặc tử vong, chủ yếu được sử dụng trong các thiết lập bổ trợ (sau phẫu thuật/xạ trị).
– PFS (Thời gian sống không tiến triển): Thời gian từ khi phân ngẫu nhiên đến khi ghi nhận sự tiến triển của khối u hoặc tử vong, thường được sử dụng trong các tình trạng tiên tiến/đã di căn.
– ORR (Tỷ lệ đáp ứng khách quan): Tỷ lệ bệnh nhân đạt được sự thu nhỏ khối u (CR hoặc PR) theo các tiêu chí chuẩn (ví dụ, RECIST 1.1 cho các khối u rắn).
– CR (Đáp ứng hoàn toàn): Biến mất tất cả các tổn thương mục tiêu và bình thường hóa các dấu hiệu khối u trong thời gian tối thiểu (thông thường ≥4 tuần).
– PR (Đáp ứng phần): Giảm ≥30% tổng đường kính của các tổn thương mục tiêu, duy trì ít nhất 4 tuần.
– SD (Bệnh ổn định): Không đủ thu nhỏ để đạt PR và không đủ tăng để đạt PD.
– PD (Bệnh tiến triển): Tăng ≥20% tổng đường kính của các tổn thương mục tiêu hoặc xuất hiện các tổn thương mới.
– DCR (Tỷ lệ kiểm soát bệnh): Tỷ lệ bệnh nhân có CR, PR hoặc SD duy trì vượt quá thời gian tối thiểu.
Kết quả chính và diễn giải lâm sàng
1. Tổng thời gian sống (OS): OS là tiêu chuẩn vàng để đánh giá lợi ích lâm sàng do tính khách quan và chính xác của nó. Đây là điểm cuối ít bị ảnh hưởng bởi sai số đo lường nhất và có thể diễn giải một cách phổ quát. Tuy nhiên, OS yêu cầu theo dõi dài hạn và mẫu lớn, và tính hữu ích của nó có thể bị nhiễu do các liệu pháp tiếp theo hoặc điều trị chuyển đổi. So sánh OS giữa các nghiên cứu khác nhau hoặc các nghiên cứu đơn tay là không đáng tin cậy do sự dị质性 inter-trial.
2. Thời gian sống không bệnh (DFS) & Thời gian sống không tiến triển (PFS): DFS và PFS đóng vai trò quan trọng như các điểm cuối thay thế, đặc biệt khi OS không khả thi do thời gian sống kéo dài hoặc ràng buộc đạo đức. DFS chủ yếu được sử dụng trong các thiết lập bổ trợ (ví dụ, sau phẫu thuật), chỉ ra thời gian cho đến khi tái phát hoặc tử vong. PFS phổ biến hơn trong các bệnh tiên tiến/đã di căn, phản ánh sự kiểm soát tiến triển của khối u. Mặc dù PFS có thể được đo sớm hơn OS, nhưng nó dễ bị ảnh hưởng bởi sai số đánh giá, đặc biệt trong các thử nghiệm mở nhãn hoặc đơn tay. Cần có các nhóm đối chứng để diễn giải có ý nghĩa. Dữ liệu hình ảnh phải được lưu trữ cẩn thận để kiểm toán và xác minh, và sự chú ý đến dữ liệu bị cắt bỏ và thiếu hụt là quan trọng đối với tính hợp lệ thống kê [2].
3. Tỷ lệ đáp ứng khách quan (ORR), Đáp ứng hoàn toàn (CR) và Đáp ứng phần (PR): ORR, được tính bằng tổng CR và PR, là một thước đo trực tiếp về sự thu nhỏ khối u và được sử dụng rộng rãi trong các giai đoạn sớm và các thiết lập phê duyệt nhanh. Tuy nhiên, ORR một mình không phản ánh được thời gian hoặc chất lượng của đáp ứng. Đối với các loại thuốc có ORR cao hoặc chưa từng có, đặc biệt là trong các loại ung thư kháng trị hoặc hiếm gặp, các cơ quan quản lý có thể cấp các phê duyệt có điều kiện chờ xác nhận lợi ích trong PFS hoặc OS. CR và PR được định nghĩa rõ ràng bởi RECIST hoặc các tiêu chí tương tự và phải kéo dài tối thiểu (≥4 tuần) để được tính.
4. Tỷ lệ kiểm soát bệnh (DCR), Bệnh ổn định (SD) và Bệnh tiến triển (PD): DCR mở rộng việc đánh giá đáp ứng bằng cách bao gồm bệnh nhân có SD kéo dài, công nhận rằng sự ổn định bệnh có thể mang lại lợi ích lâm sàng có ý nghĩa, đặc biệt đối với các tác nhân ức chế sinh trưởng. SD được định nghĩa là không có sự thay đổi đủ để đạt PR hoặc PD, trong khi PD chỉ ra sự xấu đi rõ ràng của bệnh. DCR đặc biệt liên quan trong các thiết lập mà sự thu nhỏ khối u ít gặp nhưng sự ổn định bệnh phổ biến. Công thức tính: DCR = CR + PR + SD (đủ thời gian tối thiểu), trong khi ORR = CR + PR.
Bình luận chuyên gia
Việc lựa chọn và diễn giải các điểm cuối phải được tùy chỉnh theo bối cảnh bệnh, cơ chế điều trị và nhu cầu của bệnh nhân. OS vẫn là thước đo hiệu quả chính xác nhất, nhưng quy định và thực hành lâm sàng ngày càng công nhận giá trị của các điểm cuối thay thế như PFS và ORR, đặc biệt trong các thiết lập có nhu cầu chưa đáp ứng cao hoặc phát triển thuốc nhanh chóng. Hạn chế của mỗi điểm cuối—như sự dễ bị ảnh hưởng bởi sai số đánh giá của PFS hoặc không phản ánh độ bền của ORR—nổi bật tầm quan trọng của việc báo cáo toàn diện các điểm cuối, bao gồm thời gian đáp ứng và thời gian đến đáp ứng.
Các tổ chức hướng dẫn, bao gồm Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA), Cơ quan Dược phẩm châu Âu (EMA) và Trung tâm Đánh giá Dược phẩm Trung Quốc (CDE), khuyến nghị các thử nghiệm phải bảo tồn dữ liệu hình ảnh và nguồn gốc, xác định trước các khoảng thời gian đánh giá và ghi rõ tiêu chí cho sự tiến triển và đáp ứng. Cuối cùng, việc tích hợp nhiều điểm cuối, được đặt trong bối cảnh cụ thể của loại ung thư và quần thể bệnh nhân, cung cấp đánh giá hiệu quả lâm sàng vững chắc nhất.
Kết luận
Chính xác hiểu định nghĩa, ưu điểm và hạn chế của OS, DFS, PFS, ORR, CR, PR, SD, PD và DCR là thiết yếu để diễn giải chính xác các thử nghiệm lâm sàng về ung thư và đưa ra quyết định có thông tin. Các điểm cuối này, khi được lựa chọn và diễn giải phù hợp, giúp các bác sĩ và nhà nghiên cứu chuyển đổi kết quả thử nghiệm thành lợi ích thực tế cho bệnh nhân mắc ung thư.
Tài liệu tham khảo
[1] Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71(3):209-249.
[2] Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009;45(2):228-247.