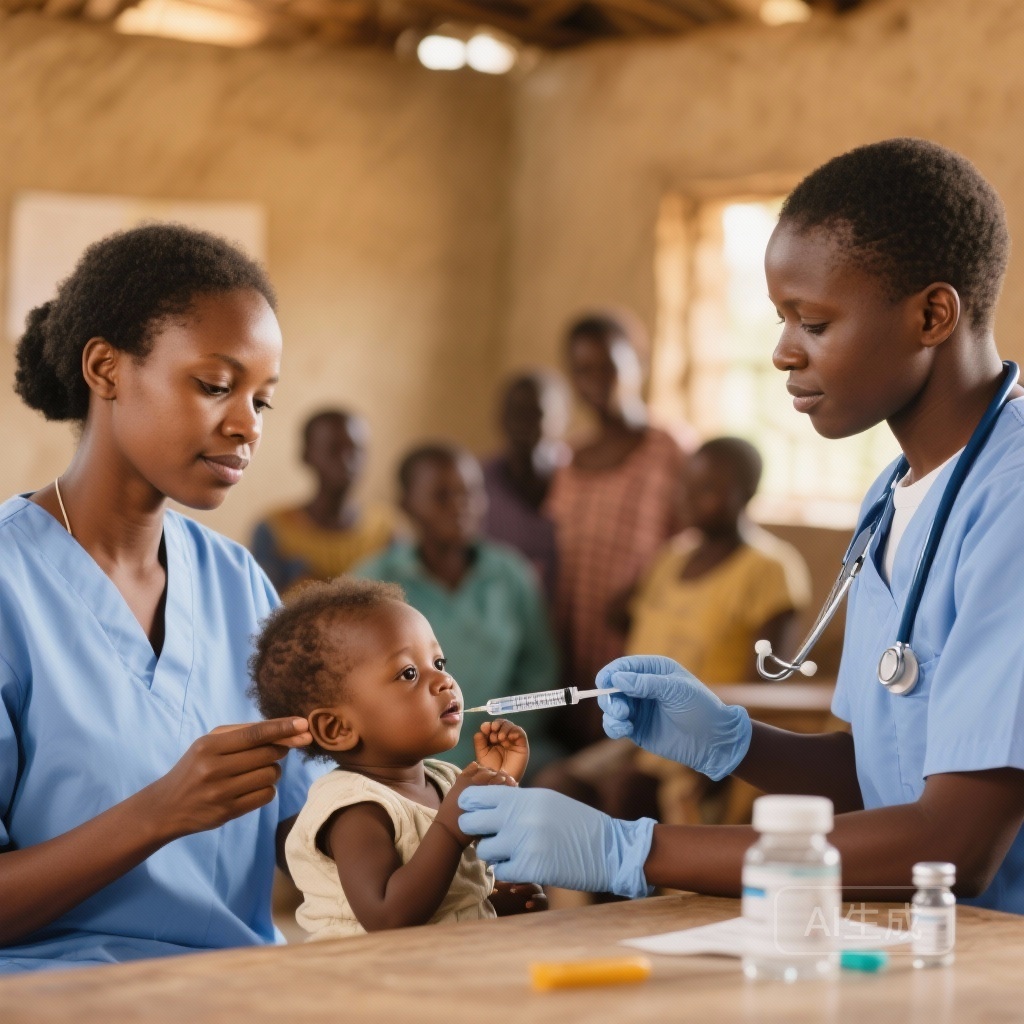
EuTCV Vi-CRM197 (Đơn liều và Đa liều) Không thua kém Typbar TCV ở Trẻ sơ sinh và Tốt lành trong Các Nhóm Tuổi tại Kenya và Senegal
Một thử nghiệm lâm sàng giai đoạn 3 đa trung tâm cho thấy EuTCV (Vi-CRM197) đơn liều và đa liều không thua kém Typbar TCV về miễn dịch học ở trẻ sơ sinh 9-12 tháng tuổi, với mức độ an toàn và phản ứng tương đương nhau giữa các nhóm tuổi — hỗ trợ việc WHO cấp giấy chứng nhận.