Những điểm nổi bật
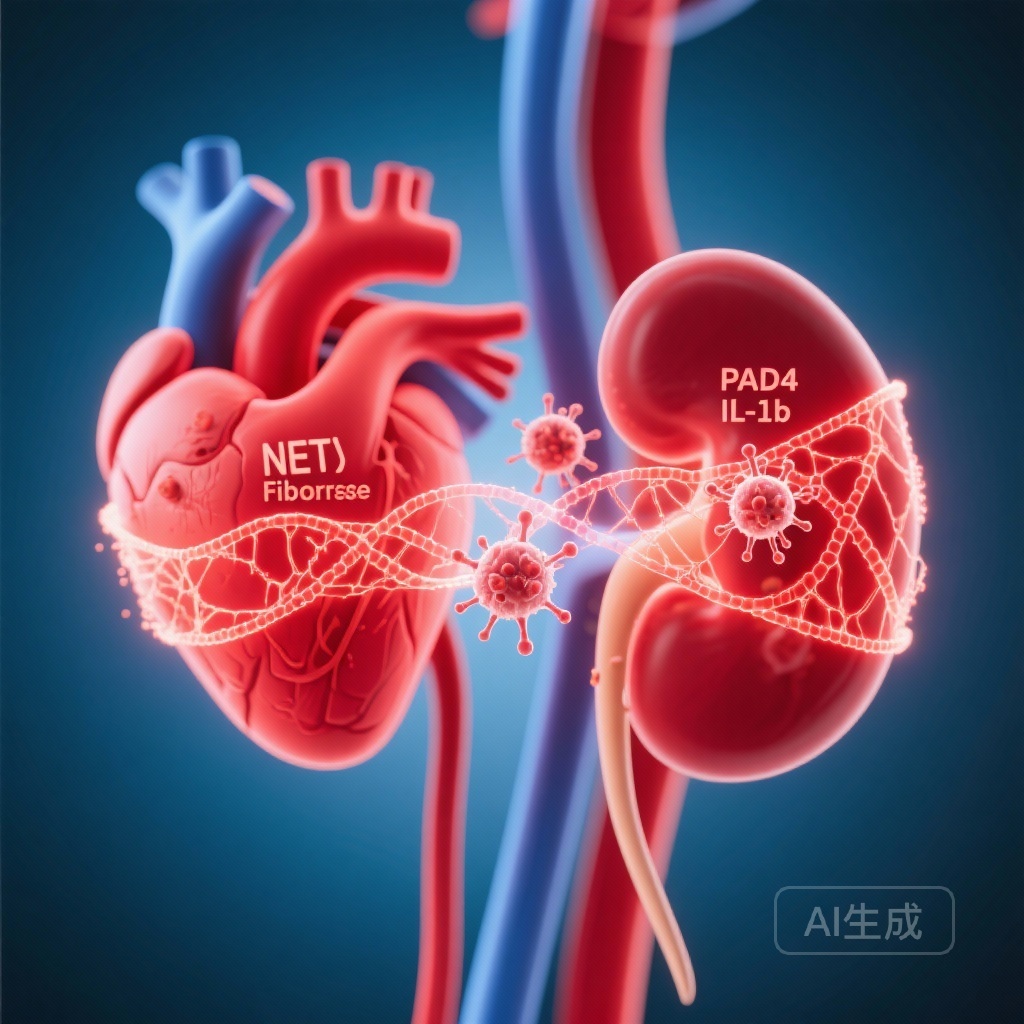
– Đái tháo đường làm tăng gánh nặng bẫy ngoại bào trung tính (NETs) trong cơ tim và thúc đẩy kích hoạt inflammasome của trung tính ở người và chuột.
– Sự thiếu hụt PAD4 ở chuột ngăn chặn hình thành NETs và ASC speck do đường gây ra, giảm IL-1β, VWF, xâm nhập trung tính, xơ hóa và bảo tồn chức năng tim và thận sau đái tháo đường thí nghiệm.
– Nghiên cứu này liên kết hình thành NETs phụ thuộc PAD4 và tín hiệu inflammasome là các tác nhân cơ chế của tổn thương tim thận do đái tháo đường và xác định PAD4/NETs là các mục tiêu điều trị tiềm năng.
Nền tảng: gánh nặng bệnh tật và nhu cầu chưa đáp ứng
Cả bệnh tim mạch và bệnh thận mạn tính đều là biến chứng chính của đái tháo đường và chiếm một phần lớn tỷ lệ mắc bệnh, tử vong và chi phí y tế trên toàn thế giới. Bệnh cơ tim đái tháo đường (DCM) và bệnh thận đái tháo đường (DKD) chia sẻ các đặc điểm bệnh lý chung—viêm mãn tính cấp độ thấp, rối loạn vi mạch, tái cấu trúc ma trận ngoại bào, và xơ hóa tiến triển—góp phần vào suy tim và suy thận tiến triển. Dù có những tiến bộ trong các liệu pháp hạ đường huyết và thuốc bảo vệ tim thận gần đây (ví dụ, ức chế SGLT2), vẫn còn một nguy cơ dư còn đáng kể và các tác nhân tế bào liên kết giữa tăng đường huyết và xơ hóa cơ quan chưa được xác định đầy đủ.
Thiết kế nghiên cứu
Nghiên cứu được tham chiếu (Schommer et al., Eur Heart J. 2025) đã kiểm tra vai trò của peptidylarginine deiminase 4 (PAD4), bẫy ngoại bào trung tính (NETs), và kích hoạt inflammasome trong tổn thương tim thận liên quan đến đái tháo đường ở người và thí nghiệm.
Các yếu tố chính:
- Phần con người: sinh thiết nội tâm mạc (EMB) từ 20 bệnh nhân suy tim có và không có đái tháo đường đã được phân tích về gánh nặng NETs.
- Nghiên cứu chuột: chuột hoang dại (WT) và chuột PAD4−/− đã nhận streptozotocin (STZ) để gây đái tháo đường thí nghiệm. Các đánh giá theo thời gian bao gồm glucose máu, cân nặng, chức năng tim, khả năng chịu đựng vận động, và phù phổi.
- Thử nghiệm tế bào: trung tính người và chuột được tiếp xúc với glucose cao để đánh giá NETosis và kích hoạt inflammasome (hình thành ASC speck). Các phép đo bao gồm hiển vi confocal, ELISA cho IL-1β và von Willebrand factor (VWF), phân tích dòng chảy, và đánh giá xơ hóa histologic (Sirius Red/Fast Green). Chức năng thận được đánh giá bằng albumin niệu và histology.
Kết quả chính
Nghiên cứu báo cáo một tập hợp các quan sát đồng nhất liên kết giữa tăng đường huyết và viêm do trung tính và xơ hóa cơ quan:
1. Gánh nặng NETs trong cơ tim tăng ở bệnh nhân đái tháo đường
Sinh thiết nội tâm mạc từ bệnh nhân suy tim có đái tháo đường cho thấy gánh nặng NETs tăng so với những người không có đái tháo đường, hỗ trợ tính lâm sàng của NETs trong tổn thương tim do đái tháo đường.
2. Glucose cao kích hoạt inflammasome của trung tính
Tiếp xúc của trung tính người với điều kiện glucose cao kích hoạt inflammasome như được chứng minh bằng hình thành ASC speck; điều này cung cấp một liên kết cơ chế giữa tăng đường huyết và kích hoạt miễn dịch bẩm sinh.
3. PAD4 cần thiết cho NETosis và kích hoạt inflammasome do đái tháo đường gây ra ở chuột
Cả chuột WT và PAD4−/− đều phát triển tăng đường huyết và mất cân nặng sau STZ, chỉ ra sự tổn thương đường huyết tương đương. Tuy nhiên, chỉ có trung tính WT cho thấy tăng NETosis và hình thành ASC speck sau khi đái tháo đường. Trung tính PAD4−/− kháng lại việc hình thành NET do glucose cao và tín hiệu inflammasome—ngụ ý PAD4 là tác nhân quan trọng.
4. Sự thiếu hụt PAD4 bảo vệ chống lại chức năng tim kém và viêm hệ thống liên quan đến đái tháo đường
Chỉ có chuột WT đái tháo đường biểu hiện IL-1β và VWF tuần hoàn tăng, chức năng tim suy giảm, khả năng chịu đựng vận động giảm và phù phổi. Chuột đái tháo đường PAD4−/− được bảo vệ khỏi các biểu hiện bất lợi này mặc dù có mức đường huyết tương đương. Những phát hiện này gợi ý rằng NETosis do PAD4 gây ra làm tăng viêm hệ thống và rối loạn nội mô trong đái tháo đường.
5. PAD4 thúc đẩy viêm và xơ hóa tim và thận
Phân tích histologic cho thấy xơ hóa tim và thận, xâm nhập trung tính, lắng đọng NETs, và mức độ transforming growth factor-β1 (TGF-β1) tăng hơn ở chuột WT đái tháo đường. Chức năng, chuột WT phát triển albumin niệu và xơ hóa thận phù hợp với DKD, trong khi chuột đái tháo đường PAD4−/− bảo tồn chức năng thận và có ít thay đổi xơ hóa.
6. Diễn giải tổng hợp
Tổng hợp lại, dữ liệu hỗ trợ mô hình trong đó tăng đường huyết kích thích kích hoạt inflammasome của trung tính và NETosis phụ thuộc PAD4; NETs và IL-1β do inflammasome tạo ra làm tăng kích hoạt nội mô (như được phản ánh bởi VWF), thu hút nhiều trung tính hơn, và thúc đẩy quá trình xơ hóa do TGF-β1 trong tim và thận, cuối cùng dẫn đến suy giảm chức năng và suy tim.
Nhận thức cơ chế và chuyển đổi
Nghiên cứu này cung cấp cả chiều sâu cơ chế và liên quan chuyển đổi. Các nút quan trọng về cơ chế bao gồm:
- Citrullination histone do PAD4: PAD4 citrullinate histone, thúc đẩy mở rộng chromatin và giải phóng NETs—bước trung tâm trong NETosis.
- Inflammasome trung tính: Hình thành ASC speck chỉ ra kích hoạt phức hợp inflammasome (ví dụ, NLRP3) trong trung tính, kết thúc bằng sự kích hoạt caspase-1 và giải phóng IL-1β; IL-1β là một cytokine mạnh mẽ gây xơ hóa và viêm.
- Trò chuyện với nội mô mạch máu và các con đường xơ hóa: Các thành phần NETs và IL-1β gây rối loạn nội mô (phóng thích VWF) và biểu hiện TGF-β1, thúc đẩy sự lắng đọng collagen và xơ hóa cơ quan.
Những con đường này là hợp lý về mặt sinh học và phù hợp với các tài liệu trước đây liên kết NETs với viêm vô khuẩn, cục máu đông, và tổn thương mô (Brinkmann et al., 2004; Papayannopoulos, 2018) và chỉ ra rằng tín hiệu inflammasome/IL-1β trong viêm chuyển hóa (Vandanmagsar et al., 2011).
Nhận thức lâm sàng và điều trị
Các cơ hội chuyển đổi chính phát sinh từ việc ngắt trục PAD4-NET-inflammasome:
- Ức chế PAD4: Sự thiếu hụt gen PAD4 bảo vệ ở chuột; các chất ức chế PAD4 chọn lọc (đang phát triển tiền lâm sàng/sớm lâm sàng) có thể giảm NETosis và hậu quả xơ hóa do hạ đường huyết.
- Chiến lược nhắm mục tiêu NETs: Các liệu pháp dựa trên DNase phân hủy DNA ngoại bào hoặc các chất cản trở hình thành NETs có thể được sử dụng lại hoặc thử nghiệm để bảo vệ tim thận.
- Ức chế inflammasome/IL-1β: Các thử nghiệm lâm sàng (ví dụ, CANTOS, Ridker et al.) hỗ trợ ức chế IL-1β để giảm nguy cơ tim mạch; nghiên cứu này gợi ý rằng ức chế IL-1β cũng có thể điều chỉnh các phản ứng xơ hóa tim thận trong đái tháo đường, mặc dù cần nghiên cứu về hiệu quả cụ thể theo cơ quan.
- Phát triển dấu hiệu sinh học: Các dấu hiệu sinh học tuần hoàn của NETosis (DNA tự do, histone H3 citrullinated) và kích hoạt inflammasome có thể phục vụ như các dấu hiệu sinh học cơ chế để xác định bệnh nhân có nguy cơ cao hoặc theo dõi phản ứng đối với các can thiệp mục tiêu.
Lợi thế và hạn chế của nghiên cứu
Lợi thế:
- Thiết kế chuyển đổi kết hợp quan sát mô người với thí nghiệm cơ chế chuột và tế bào.
- Sử dụng xóa gen PAD4 để chứng minh tính nhân quả in vivo.
- Phân loại toàn diện về cấu trúc và chức năng tim và thận.
Hạn chế:
- Đái tháo đường do STZ chủ yếu mô phỏng mất tế bào beta giống như loại 1; bệnh lý có thể khác biệt so với đái tháo đường loại 2, chiếm phần lớn bệnh tim thận ở người.
- Xóa gen toàn cầu PAD4 có thể có tác động phát triển hoặc miễn dịch hệ thống khác biệt so với ức chế dược lý ở người lớn; cách tiếp cận cụ thể tế bào (hạn chế trung tính) sẽ tinh chỉnh gán trách nhiệm.
- Dữ liệu người bị hạn chế ở một nhóm nhỏ EMB (n = 20); các nghiên cứu người lớn hơn là cần thiết để lượng hóa các mối liên hệ qua các loại và giai đoạn đái tháo đường.
- Những lo ngại về an toàn điều trị: nhắm mục tiêu NETosis hoặc PAD4 có thể làm suy giảm khả năng phòng vệ của cơ thể chống lại nhiễm trùng; việc chuyển đổi lâm sàng sẽ yêu cầu đánh giá cẩn thận về rủi ro-lợi ích.
Hướng đi trong tương lai
Các bước ưu tiên tiếp theo bao gồm:
- Xác nhận các dấu hiệu sinh học NETs và inflammasome trong các nhóm người lớn hơn có đái tháo đường và tương quan triển vọng với kết quả tim thận.
- Thử nghiệm tiền lâm sàng các chất ức chế PAD4 chọn lọc và chiến lược phân hủy NETs trong các mô hình đái tháo đường loại 2 và bệnh kèm theo, với đánh giá về khả năng phòng vệ và nguy cơ nhiễm trùng.
- Khám phá các chiến lược kết hợp—ví dụ, liệu pháp nhắm mục tiêu PAD4/NETs cộng thêm ức chế SGLT2 hoặc chất chống xơ hóa—to đánh giá bảo vệ tim thận cộng thêm hoặc hiệp đồng.
- Thử nghiệm lâm sàng giai đoạn sớm ở các nhóm người đái tháo đường được phân loại cẩn thận với các điểm kết thúc về cấu trúc, chức năng tim và thận và dấu hiệu sinh học của NETosis/viêm.
Kết luận
Nghiên cứu của Schommer và đồng nghiệp cung cấp bằng chứng thực nghiệm thuyết phục rằng hình thành NETs phụ thuộc PAD4 và kích hoạt inflammasome của trung tính là các liên kết cơ chế giữa tăng đường huyết và viêm, xơ hóa và suy giảm chức năng tim thận. Những phát hiện này chuyển sự chú ý hướng tới viêm vô khuẩn do trung tính là con đường có thể tác động trong các biến chứng đái tháo đường và hỗ trợ việc điều tra lâm sàng các liệu pháp nhắm mục tiêu PAD4/NETs, với sự chú ý cẩn thận đến các khoảng cách chuyển đổi và các xem xét về an toàn.
Kinh phí và clinicaltrials.gov
Bài viết nguồn liệt kê các khoản kinh phí và tuyên bố tiết lộ; độc giả nên tham khảo bài viết gốc (Schommer et al., Eur Heart J. 2025; DOI: 10.1093/eurheartj/ehaf963) để biết thông tin chi tiết về tài trợ và xung đột lợi ích. Không có các thử nghiệm lâm sàng đã đăng ký được báo cáo trong công việc tiền lâm sàng/quan sát được tóm tắt.
Tài liệu tham khảo
Schommer N, et al. Neutrophil extracellular traps and peptidylarginine deiminase 4-mediated inflammasome activation link diabetes to cardiorenal injury and heart failure. Eur Heart J. 2025 Nov 27:ehaf963. doi: 10.1093/eurheartj/ehaf963. PMID: 41307910.
Brinkmann V, Reichard U, Goosmann C, et al. Neutrophil extracellular traps kill bacteria. Science. 2004;303(5663):1532-1535.
Papayannopoulos V. Neutrophil extracellular traps in immunity and disease. Nat Rev Immunol. 2018;18(2):134-147.
Li P, Li M, Lindberg MR, Kennett MJ, Xiong N, Wang Y. PAD4 is essential for antibacterial innate immune responses mediated by neutrophil extracellular traps. J Exp Med. 2010;207(9):1853-1862.
Vandanmagsar B, Youm YH, Ravussin A, et al. The NLRP3 inflammasome instigates obesity-induced inflammation and insulin resistance. Nature. 2011;470(7336): 6-8 (ghi chú: tài liệu tham khảo điển hình về viêm chuyển hóa inflammasome).
Ridker PM, Everett BM, Thuren T, et al. Antiinflammatory Therapy with Canakinumab for Atherosclerotic Disease. N Engl J Med. 2017;377(12):1119-1131.
Bài viết liên quan
– Papayannopoulos V. NETs trong tổn thương mô vô khuẩn—các bài đánh giá chi tiết về NETs và tổn thương cơ quan.
– Li P, et al. PAD4 và NETosis—các nghiên cứu cơ chế nền tảng.
Ghi chú của tác giả
Bài viết này được viết cho các bác sĩ lâm sàng và nhà nghiên cứu chuyển đổi để tóm tắt và diễn giải phê bình các phát hiện của Schommer et al. (2025) trong bối cảnh kiến thức hiện tại về NETs, PAD4 và sinh học inflammasome. Nó không phải là lời khuyên y tế.