Những điểm nổi bật
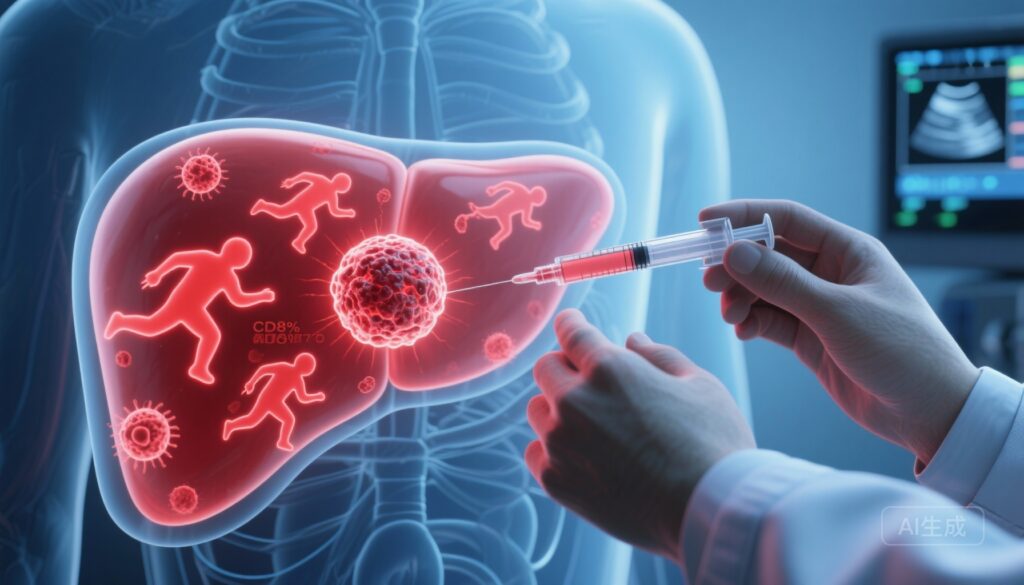
– VG161, một loại oncolytic HSV-1 đa vũ trang mã hóa IL-12, IL-15 và đối thủ của PD-L1, được dung nạp tốt và tạo ra kích hoạt miễn dịch khách quan ở 24 bệnh nhân mắc ung thư ống mật gan tiến triển (ICC).
– Phân tích đa omics trên các mẫu sinh thiết u theo thời gian cho thấy mở rộng tế bào trình diện kháng nguyên (APC), kích hoạt tế bào T CD8+ và giảm tế bào đại thực bào M2; transcriptomics đơn tế bào và không gian đề cử các phân nhóm tế bào biểu mô (Epi-C2) và đại thực bào (Macro-C1QC) làm dấu hiệu sinh học đáp ứng.
– Các tín hiệu lâm sàng bao gồm hoạt động chống u hứa hẹn trong nhóm bệnh nhân đã được điều trị nhiều lần và lợi ích sống còn tổng thể so với FOLFOX tuyến thứ hai lịch sử; tiếp xúc trước đó với chất ức chế điểm kiểm soát miễn dịch (CPIs) liên quan đến lợi ích tăng cường.
Nền tảng: Nhu cầu chưa được đáp ứng trong ung thư ống mật gan
Ung thư ống mật gan (ICC) là một khối u sinh học hung hãn của niêm mạc ống mật với tỷ lệ mắc ngày càng tăng ở nhiều khu vực và tiên lượng tổng thể kém. Hầu hết bệnh nhân được phát hiện ở giai đoạn tiến triển; hóa trị liệu toàn thân (gemcitabine-cisplatin tuyến đầu) cung cấp lợi ích sống sót khiêm tốn, và các lựa chọn sau khi tiến triển là hạn chế. FOLFOX tuyến thứ hai đã được áp dụng dựa trên bằng chứng ngẫu nhiên cho các bệnh về đường mật, nhưng kết quả vẫn không hài lòng cho nhiều bệnh nhân. Có nhu cầu cấp bách về các chiến lược điều trị mới tạo ra phản ứng kéo dài hoặc chuyển đổi các khối u trước đây ‘lạnh’ về miễn dịch thành môi trường nhạy cảm với điều trị.
Lý do điều trị cho VG161
Các virus oncolytic cung cấp cơ chế kép: hoại tử tế bào u có chọn lọc cộng với việc gây ra miễn dịch chống u thông qua việc giải phóng kháng nguyên và kích thích miễn dịch cục bộ. VG161 là một loại herpes simplex virus-1 (HSV-1) được gọi là đa vũ trang vì nó biểu hiện ba gen tăng cường miễn dịch: interleukin-12 (IL-12), interleukin-15 (IL-15), và đối thủ của programmed death-ligand 1 (PD-L1). IL-12 và IL-15 hỗ trợ phản ứng miễn dịch loại 1, hỗ trợ kích hoạt tế bào T CD8+ và tế bào tự nhiên (NK) và hình thành ký ức, trong khi chặn PD-L1 cục bộ có thể giảm mệt mỏi tế bào T trong môi trường micro được tiêm. Những tính chất này cung cấp lý do sinh học rõ ràng để thử nghiệm VG161 trong ICC, một loại u thường được đặc trưng bởi mô đệm ức chế miễn dịch và xâm nhập tế bào T thấp.
Thiết kế nghiên cứu và phương pháp (phân tích tổng hợp)
Báo cáo này tổng hợp dữ liệu từ hai nghiên cứu lâm sàng đa trung tâm: một nghiên cứu giai đoạn I tăng liều và một thử nghiệm thăm dò giai đoạn IIa. Tổng cộng, 24 bệnh nhân mắc ICC tiến triển, được xác nhận bằng mô học, đã nhận các tiêm nội u hướng dẫn bởi siêu âm của VG161. Bệnh nhân đã được điều trị nhiều lần (hầu hết nhận VG161 ở tuyến thứ ba hoặc muộn hơn); một số đã có tiếp xúc trước đó với chất ức chế điểm kiểm soát miễn dịch toàn thân (CPIs). Các mẫu sinh thiết u được thu thập theo thời gian cho phân tích đa omics, bao gồm transcriptomics tổng thể, transcriptomics RNA đơn tế bào và transcriptomics không gian, để khảo sát các thay đổi miễn dịch trong môi trường micro u (TME). An toàn, đáp ứng u khách quan và kết quả sống còn được đánh giá; kết quả được so sánh với dữ liệu FOLFOX tuyến thứ hai lịch sử để cung cấp tiêu chuẩn giả thuyết.
Các phát hiện lâm sàng chính
An toàn: VG161 nói chung được dung nạp tốt khi tiêm nội u vào các tổn thương gan bằng siêu âm. Các tác dụng phụ phù hợp với việc truyền virus cục bộ và kích thích miễn dịch; không có tín hiệu an toàn mới cản trở việc phát triển thêm được báo cáo trong nhóm tổng hợp.
Hoạt động chống u: Mặc dù được quản lý chủ yếu ở tuyến thứ ba hoặc muộn hơn, VG161 đã thể hiện hoạt động chống u hứa hẹn trong nhóm nhỏ. Dữ liệu tổng hợp báo cáo co rút u khách quan ở một số bệnh nhân và lợi ích lâm sàng ở những người đã được điều trị nhiều lần. Các tác giả lưu ý tín hiệu sống còn tổng thể cải thiện so với các đối chứng lịch sử được điều trị bằng FOLFOX tuyến thứ hai — một phát hiện gợi ý cho thấy VG161 được sử dụng ở các tuyến muộn hơn — mặc dù phân tích là giả thuyết thay vì quyết định.
Tương tác với tiếp xúc CPI trước đó: Phân tích thăm dò chỉ ra rằng bệnh nhân đã từng nhận chất ức chế điểm kiểm soát miễn dịch toàn thân (CPIs) có lợi ích tăng cường từ VG161. Quan sát này cho thấy VG161 có thể đặc biệt hiệu quả trong việc tái kích hoạt hoặc mở rộng miễn dịch chống u đã được CPIs ban đầu kích hoạt hoặc kích hoạt một phần.
Các tương quan miễn dịch và phân tử từ phân tích đa omics
Sức mạnh dịch chuyển của nghiên cứu tổng hợp nằm ở việc phân tích mô vải độ phân giải cao theo thời gian. Các thay đổi chính được quan sát sau khi quản lý VG161 bao gồm:
- Mở rộng và kích hoạt tế bào trình diện kháng nguyên (tế bào trung gian và các quần thể APC tủy xương liên quan), phù hợp với việc trình diện kháng nguyên u tăng cường.
- Xâm nhập và kích hoạt mạnh mẽ tế bào T CD8+, với các dấu hiệu transcriptomics chỉ ra chức năng tác động độc tế bào.
- Giảm số lượng tế bào đại thực bào liên quan đến u có tính chất M2, ức chế miễn dịch, gợi ý về việc lập trình lại các khoang myeloid ức chế.
Transcriptomics đơn tế bào và không gian giải quyết thêm sự đồng nhất nội u và đề cử các phân nhóm tế bào liên quan đến đáp ứng hoặc kháng thuốc: một phân cụm biểu mô (được chỉ định là Epi-C2) và một cụm đại thực bào (Macro-C1QC). Các quần thể này tương quan với sự tuyển dụng tế bào miễn dịch khác biệt và các mẫu kích hoạt không gian, khiến chúng trở thành các ứng viên dấu hiệu sinh học có thể thử nghiệm trong các nghiên cứu tiếp theo.
Giải thích cơ chế
Các gen của VG161 cung cấp cơ sở cơ chế cho sự tái cấu trúc miễn dịch được quan sát. IL-12 thúc đẩy sự biệt hóa Th1 và tăng cường độc tính tế bào T CD8+ và tế bào tự nhiên (NK); IL-15 hỗ trợ sự phân chia và sống còn của tế bào T CD8+ và tế bào NK có ký ức; và chặn PD-L1 cục bộ giảm tín hiệu ức chế có thể làm suy yếu chức năng tế bào T tác động. Sự nhân lên virus nội u gây ra sự giải phóng kháng nguyên u và các dấu hiệu viêm cục bộ cùng nhau chuyển đổi các khối u lạnh thành môi trường bị viêm nhạy cảm với tấn công miễn dịch thích ứng. Sự giảm hoặc lập trình lại tế bào đại thực bào M2 được quan sát ở đây phù hợp với sự chuyển dịch miễn dịch từ mô đệm ức chế sang cho phép.
Nghĩa lâm sàng và các hướng phát triển tiềm năng
Dữ liệu này hỗ trợ nhiều chiến lược dịch chuyển:
- Đánh giá ngẫu nhiên của VG161 so với hoặc kết hợp với các tiêu chuẩn toàn thân (ví dụ, hóa trị liệu, CPIs) ở các tuyến điều trị sớm hơn để xác định xem các tín hiệu được quan sát ở đây có chuyển thành lợi ích sống sót có ý nghĩa, có thể lặp lại hay không.
- Các phác đồ kết hợp ghép VG161 với các chất ức chế PD-1/PD-L1 toàn thân hoặc các chất điều chỉnh miễn dịch khác, vì VG161 vừa cung cấp chặn PD-L1 cục bộ và dường như có sự cộng hưởng với tiếp xúc CPI trước đó.
- Xác minh triển vọng của các ứng viên dấu hiệu sinh học (Epi-C2, Macro-C1QC) để làm giàu cho bệnh nhân có khả năng hưởng lợi cao nhất hoặc để theo dõi các đáp ứng sinh học trong quá trình điều trị.
- Hoàn thiện các tiêu chí lựa chọn bệnh nhân và các xem xét về an toàn cho việc tiêm nội u vào tổn thương gan, bao gồm các tiêu chí lựa chọn bệnh nhân cho khả năng tiếp cận và các xem xét về an toàn cho các lần tiêm lặp đi lặp lại.
Điểm mạnh và hạn chế
Điểm mạnh của phân tích tổng hợp bao gồm việc tích hợp kết quả lâm sàng với dữ liệu đa omics mô vải theo thời gian, cho phép liên kết trực tiếp giữa các tác động sinh học và các tín hiệu lâm sàng. Tính chất đa trung tâm của các nghiên cứu hỗ trợ khả năng tổng quát hóa trong các bối cảnh điều trị, và việc bao gồm bệnh nhân đã được điều trị nhiều lần nhấn mạnh hoạt động của liệu pháp trong một dân số có nhu cầu cao.
Các hạn chế quan trọng và làm dịu cách diễn giải: phân tích nhỏ (n=24) và không ngẫu nhiên, cản trở việc đưa ra các tuyên bố hiệu quả quyết định. So sánh với FOLFOX tuyến thứ hai là lịch sử thay vì đồng thời và do đó dễ bị sai lệch lựa chọn và nhiễu. Sự đồng nhất trong các điều trị trước đó và thời gian lấy mẫu sinh thiết làm phức tạp thêm việc suy luận nhân quả. Cuối cùng, việc tiêm nội u đặt ra các xem xét về mặt hậu cần; việc kiểm soát miễn dịch hệ thống lâu dài sẽ yêu cầu chứng minh rằng liệu pháp cục bộ có thể tạo ra các tác động xa (abscopal) có ý nghĩa lâm sàng.
Bình luận chuyên gia
VG161 đại diện cho sự tiến hóa hợp lý trong liệu pháp vi rút oncolytic — kết hợp hoại tử trực tiếp với việc cung cấp cytokines và chặn điểm kiểm soát cục bộ để thúc đẩy kích hoạt miễn dịch đa chế độ. Dữ liệu dịch chuyển ở đây là thuyết phục cho công việc giai đoạn sớm: việc chứng minh tuyển dụng APC, kích hoạt CD8+ và lập trình lại đại thực bào cung cấp bằng chứng cơ chế hỗ trợ các tín hiệu lâm sàng được quan sát. Tuy nhiên, sự nhiệt tình phải cân nhắc với nhu cầu đánh giá ngẫu nhiên nghiêm ngặt và xác minh dấu hiệu sinh học. Nếu được xác nhận, VG161 hoặc các nền tảng oncolytic đa vũ trang tương tự có thể trở thành một phương thức hữu ích trong ICC, nơi các liệu pháp toàn thân thông thường để lại nhu cầu chưa được đáp ứng.
Kết luận
Đánh giá tổng hợp giai đoạn I/IIa của VG161 trong ung thư ống mật gan tiến triển cho thấy rằng một loại oncolytic HSV-1 đa vũ trang tiêm nội u có thể an toàn gây ra tái cấu trúc miễn dịch cục bộ đáng kể và cung cấp các tín hiệu lâm sàng sớm về hoạt động, thậm chí trong một dân số đã được điều trị nhiều lần. Tiếp xúc CPI trước đó có thể tăng cường đáp ứng, và phân tích đa omics đã xác định các ứng viên dấu hiệu sinh học tế bào để nghiên cứu tiếp theo. Những kết quả giả thuyết này biện minh cho các thử nghiệm ngẫu nhiên để xác định lợi ích lâm sàng, các phác đồ tối ưu và dấu hiệu sinh học dự đoán.
Quỹ tài trợ và clinicaltrials.gov
Tài trợ, nhà tài trợ và chi tiết đăng ký thử nghiệm đầy đủ được báo cáo trong bản manu gốc: Shen Y et al., Gut. 2025 (gutjnl-2025-335904). Người đọc nên tham khảo ấn phẩm gốc để biết các thông tin định danh và công nhận tài trợ đầy đủ.
Tài liệu tham khảo
1. Shen Y, Jin X, Song W, et al. Đánh giá giả thuyết của oncolytic HSV-1 đa vũ trang (VG161) trong ung thư ống mật gan: thông tin tổng hợp từ các nghiên cứu đa trung tâm. Gut. 2025 Sep 29:gutjnl-2025-335904. doi:10.1136/gutjnl-2025-335904.
2. Andtbacka RH, Kaufman HL, Collichio F, et al. Talimogene laherparepvec cải thiện tỷ lệ đáp ứng kéo dài ở bệnh nhân mắc ung thư hắc tố tiến triển. J Clin Oncol. 2015;33(25):2780–2788. doi:10.1200/JCO.2014.58.3377.
3. Lamarca A, Palmer DH, Wasan HS, et al. ABC-06: Một thử nghiệm ngẫu nhiên giai đoạn III về hóa trị liệu FOLFOX tuyến thứ hai so với kiểm soát triệu chứng chủ động cho ung thư đường mật tiến triển. Lancet Oncology. 2021. [Xem báo cáo thử nghiệm gốc để biết trích dẫn và chi tiết đầy đủ]
Ghi chú
Bài viết này tổng hợp và diễn giải các kết quả tổng hợp được báo cáo bởi Shen et al. (Gut, 2025) và đặt chúng trong bối cảnh lâm sàng và cơ chế. Các kết luận ở đây nhằm tạo ra giả thuyết và thông tin cho các bác sĩ và nhà nghiên cứu xem xét các phương pháp liệu pháp vi rút oncolytic trong các khối u đường mật.