Những điểm nổi bật
– Miễn dịch hóa trị liệu bằng bạch kim cộng với ức chế PD-1/PD-L1 đạt tỷ lệ đáp ứng bệnh lý hoàn toàn (pCR) 51.7% trong 29 trường hợp NSCLC có thể cắt bỏ có biến đổi SMARCA4; lợi ích tập trung ở tổ chức học biểu mô vảy (pCR 83.3% so với 28.6% ở adenocarcinoma, p=0.045).
– Các khối u adenocarcinoma có biến đổi SMARCA4 có các kiểu miễn dịch đa dạng; các trường hợp không có tế bào miễn dịch có tiên lượng sống kém hơn đáng kể so với các trường hợp có tế bào miễn dịch.
– Trong bệnh tiến triển, các đột biến SMARCA4 làm tăng gánh nặng đột biến (TMB) nhưng tổng thể có tiên lượng sống trung bình kém hơn; sự xuất hiện đồng thời của STK11 và/hoặc KEAP1 cùng SMARCA4 (và thường là KRAS) liên quan đến thời gian sống không tiến triển và tổng thể ngắn hơn sau hóa miễn dịch.
Nền tảng
SMARCA4 mã hóa BRG1, một tiểu đơn vị xúc tác của phức hợp tái tạo nhiễm sắc chất SWI/SNF. Các biến đổi mất chức năng SMARCA4 xảy ra ở một số trường hợp ung thư phổi không phải tế bào nhỏ (NSCLC) và đã được liên kết với sinh học tấn công, liên quan đến hút thuốc và tiên lượng xấu. Việc bổ sung ức chế điểm kiểm soát miễn dịch vào hóa trị liệu đã cải thiện kết quả tổng thể trong NSCLC có thể cắt bỏ và tiến triển, nhưng chưa rõ liệu các khối u có biến đổi SMARCA4 có hưởng lợi tương tự hay không – hoặc liệu kết quả có khác nhau tùy theo tổ chức học và ngữ cảnh đột biến đồng thời hay không.
Thiết kế nghiên cứu và phương pháp
Bài viết này tổng hợp hai phân tích hồi cứu gần đây để khám phá sự tương tác giữa các biến đổi SMARCA4 với kết quả của miễn dịch hóa trị liệu tiền phẫu thuật và bệnh tiến triển.
Nghiên cứu 1 (Peng et al., J Thorac Oncol, 2025): Dãy dữ liệu hồi cứu đơn trung tâm (Bệnh viện Nhân dân Quảng Đông) gồm 29 bệnh nhân có NSCLC có thể cắt bỏ mang biến đổi SMARCA4 đã nhận miễn dịch hóa trị liệu tiền phẫu thuật. Đặc điểm lâm sàng được liên kết với giải trình tự thế hệ mới (NGS). Các tác giả cũng đã kiểm tra Bộ sưu tập dữ liệu ung thư (TCGA) của adenocarcinoma phổi theo trạng thái SMARCA4 (giải trình tự toàn bộ exon) và sử dụng bản vẽ chức năng phân tử của BostonGene để phân loại môi trường vi miễn dịch của nhóm bị biến đổi.
Nghiên cứu 2 (Dong et al., Transl Lung Cancer Res, 2025): Phân tích dựa trên cBioPortal của 2.098 trường hợp NSCLC giai đoạn IIIB–IV (loại trừ các đột biến lái điển hình EGFR, ALK, ROS1, RET) để xem xét tần suất và tác động lâm sàng của các đột biến SMARCA4, và cụ thể là ảnh hưởng của các đột biến đồng thời STK11/KEAP1 đối với kết quả với hóa miễn dịch. Liên kết với TMB, biểu hiện PD-L1, thời gian sống không tiến triển trong liệu pháp đầu tiên (mPFS1) và thời gian sống tổng thể (mOS) được đánh giá bằng các mô hình đa biến.
Các điểm cuối chính trong các nghiên cứu bao gồm tỷ lệ đáp ứng khách quan (ORR), tỷ lệ đáp ứng bệnh lý hoàn toàn (pCR) cho các trường hợp tiền phẫu thuật, thời gian sống không sự kiện (EFS) hoặc thời gian sống không tiến triển (PFS), và thời gian sống tổng thể (OS). Phân loại miễn dịch (không có tế bào miễn dịch vs có tế bào miễn dịch) và phân tích đường dẫn được sử dụng để khám phá các tương quan sinh học.
Các phát hiện chính
Dãy dữ liệu tiền phẫu thuật (Peng et al.)
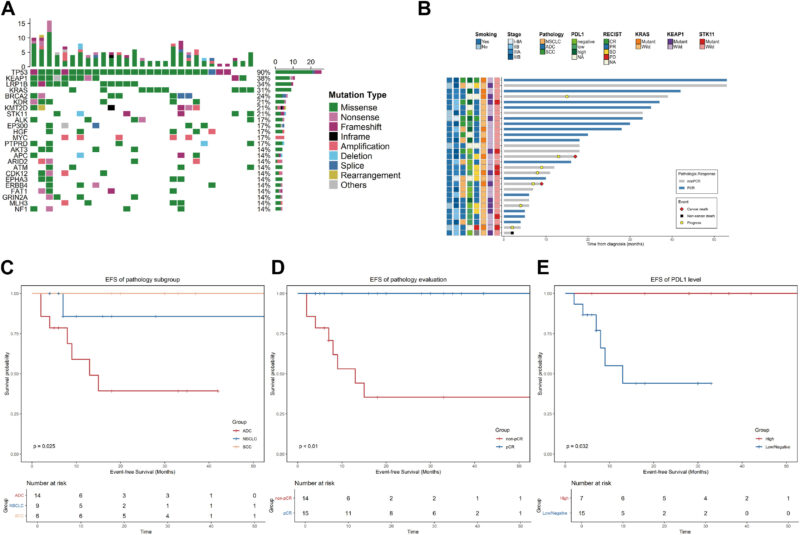
Trong 29 bệnh nhân có NSCLC có thể cắt bỏ có biến đổi SMARCA4 được điều trị bằng miễn dịch hóa trị liệu tiền phẫu thuật, tỷ lệ đáp ứng khách quan tổng thể là 70.4% và tỷ lệ pCR là 51.7%. Các phát hiện quan trọng trong nhóm bao gồm:
- Tổ chức học quan trọng: pCR khác nhau theo bệnh lý – ung thư biểu mô vảy (SCC) có tỷ lệ pCR 83.3% so với 28.6% cho adenocarcinoma (p = 0.045).
- Sự tái phát và sống còn: Sau trung bình 17 tháng theo dõi, bảy bệnh nhân tái phát; một trường hợp tử vong không do ung thư được báo cáo. Trong nhóm adenocarcinoma có tín hiệu tiến triển sớm (42.8%) với thời gian EFS trung bình ≈13 tháng, mặc dù một số bệnh nhân adenocarcinoma đạt được kiểm soát bệnh kéo dài.
- Rủi ro đột biến đồng thời: Bệnh nhân có đột biến đồng thời KRAS và KEAP1/STK11 đều tái phát trong nhóm này, gợi ý một kiểu học đặc biệt nguy cơ cao.
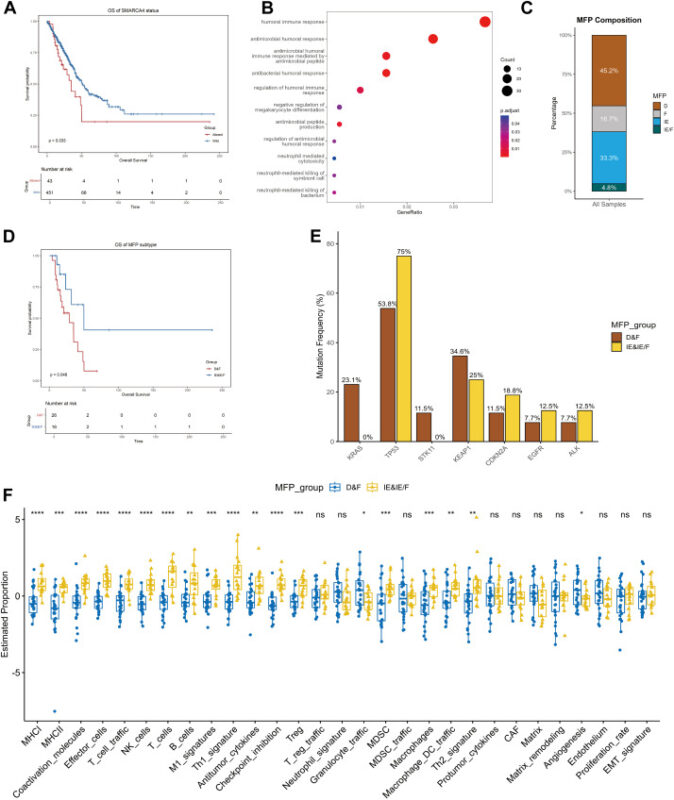
Phân tích TCGA LUAD phản ánh các quan sát lâm sàng: các khối u adenocarcinoma có biến đổi SMARCA4 có tiên lượng sống kém hơn (trung bình 34.8 tháng so với 50.9 tháng, p = 0.033) và các đặc điểm biểu hiện gen phù hợp với giảm miễn dịch bẩm sinh và tăng tín hiệu cho các đường dẫn mTOR và MYC.
Phân loại môi trường vi miễn dịch (BostonGene) tiết lộ sự đa dạng trong các khối u có biến đổi SMARCA4: cả các subtype không có tế bào miễn dịch và có tế bào miễn dịch đều có mặt. Bệnh nhân có khối u thiếu tế bào miễn dịch có thời gian sống tổng thể ngắn hơn đáng kể so với các trường hợp có tế bào miễn dịch (28.8 tháng so với 49.9 tháng, p = 0.043).
Phân tích cBioPortal bệnh tiến triển (Dong et al.)
Trong 2.098 trường hợp NSCLC tiến triển, 162 (7.7%) mang đột biến SMARCA4. Các quan sát chính bao gồm:
- Phenotype lâm sàng: Bệnh nhân có đột biến SMARCA4 thường lớn tuổi hơn, hút thuốc hiện tại hoặc trước đây, và có nhiều khả năng có di căn tuyến thượng thận.
- Đặc điểm gen và tiên lượng: Các khối u có đột biến SMARCA4 có TMB cao hơn (P<0.001) nhưng thời gian sống tổng thể trung bình kém hơn (10.6 tháng so với 17.5 tháng, P<0.001). Các đột biến SMARCA4 lớp I có thời gian sống tổng thể (mOS) và thời gian sống không tiến triển (mPFS) ngắn hơn so với các đột biến lớp II.
- Tác động của việc thêm miễn dịch: Trong các bệnh nhân có đột biến SMARCA4, hóa miễn dịch liệu pháp đầu tiên kéo dài thời gian sống không tiến triển trung bình (mPFS1) so với hóa trị liệu đơn thuần (5.6 tháng so với 3.9 tháng, P=0.01) nhưng không cải thiện mOS (10.8 tháng so với 9.5 tháng, P=0.91) ở cấp độ nhóm.
- Các yếu tố dự đoán lợi ích: Sự dương tính của PD-L1 dự đoán thời gian sống không tiến triển trung bình (mPFS1) dài hơn (8.3 tháng so với 5.1 tháng, P=0.02) và mOS (18.9 tháng so với 9.3 tháng, P=0.03) trong số những người nhận hóa miễn dịch liệu pháp; TMB không phân loại lợi ích trong nhóm này.
- Các đột biến đồng thời STK11/KEAP1: Sự hiện diện của các đột biến STK11 và/hoặc KEAP1 cùng SMARCA4 không liên quan đến TMB hoặc PD-L1, nhưng giảm đáng kể lợi ích từ hóa miễn dịch liệu pháp – mPFS1 là 4.5 tháng so với 13.3 tháng (P<0.001) và mOS 8.7 tháng so với 20.1 tháng (P=0.005) so với các đột biến SMARCA4 không có các đột biến đồng thời này. Trong quần thể có đột biến SMARCA4, bệnh nhân không có đột biến đồng thời STK11/KEAP1 có lợi ích đáng kể về mPFS1 từ miễn dịch liệu pháp; lợi ích này bị giảm hoặc không có khi có đột biến đồng thời STK11/KEAP1.
Giải thích và xem xét cơ chế
Tập hợp các phân tích này chỉ ra rằng NSCLC có biến đổi SMARCA4 không phải là một thực thể lâm sàng đơn nhất mà là một phổ được xác định bởi tổ chức học và ngữ cảnh đột biến đồng thời. Một số điểm cơ chế và dịch chuyển đáng chú ý bao gồm:
- Sự thiếu hụt SMARCA4 có thể tăng độ bất ổn định gen và TMB – có thể ủng hộ tính miễn dịch – nhưng hiệu ứng này bị phủ nhận trong các nhóm phụ bởi các đột biến đồng thời chủ động định hình môi trường vi miễn dịch.
- Mất chức năng STK11 (LKB1) đã được liên kết trong các công trình trước đây với môi trường vi miễn dịch lạnh, suy giảm tín hiệu STING và giảm xâm nhập tế bào T; mất chức năng KEAP1 kích hoạt NRF2 và các chương trình chuyển hóa có thể làm giảm thêm sự giám sát miễn dịch. Sự hiện diện đồng thời của các tổn thương này với SMARCA4 có thể thiết lập một kiểu học không có tế bào miễn dịch kém đáp ứng với ức chế điểm kiểm soát miễn dịch.
- Các đáp ứng phụ thuộc tổ chức học trong giai đoạn tiền phẫu thuật (đáp ứng bệnh lý hoàn toàn mạnh mẽ ở các trường hợp biểu mô vảy) có thể phản ánh sự khác biệt về tính miễn dịch cơ bản, bối cảnh mô chất khối u, hoặc các đột biến đồng thời giữa SCC và adenocarcinoma thay vì một hiệu ứng trực tiếp của sự mất chức năng SMARCA4.
- Các đường dẫn được làm giàu (mTOR, MYC) xác định trong adenocarcinoma có biến đổi SMARCA4 đề xuất các yếu tố dễ bị tổn thương thay thế có thể được khám phá kết hợp với miễn dịch liệu pháp để vượt qua sự kháng thuốc.
Bình luận chuyên gia và hạn chế
Các dữ liệu giả thuyết này cung cấp tín hiệu lâm sàng quan trọng nhưng có những hạn chế làm giảm khả năng dịch chuyển ngay lập tức vào thực hành:
- Kích thước và thiên lệch lựa chọn: Dãy dữ liệu tiền phẫu thuật chỉ bao gồm 29 bệnh nhân từ một trung tâm; kết quả có thể bị ảnh hưởng bởi việc lựa chọn bệnh nhân cho phẫu thuật và thực hành của cơ sở.
- Thiết kế hồi cứu: Cả hai nghiên cứu đều là hồi cứu và quan sát; nhiễu do chỉ định và thông tin lâm sàng không đầy đủ (ví dụ, liệu pháp trước đó, bệnh đồng mắc, hài hòa hóa PD-L1) có thể ảnh hưởng đến ước tính hiệu quả điều trị.
- Sự đa dạng trong thử nghiệm và phân loại đột biến: Các biến đổi SMARCA4 bao gồm các sự kiện cắt đứt, thay đổi một ký tự và cấu trúc; không phải tất cả các biến đổi đều gây mất chức năng tương đương. Các nghiên cứu giải quyết phần nào vấn đề này (lớp I vs lớp II), nhưng cần có phân loại chức năng chuẩn hóa hơn.
- Sự tương tác của dấu hiệu sinh học: PD-L1 và TMB có tính thông tin khác nhau; dữ liệu PD-L1 không đồng nhất hoặc không đầy đủ hạn chế kết luận chắc chắn về vai trò dự đoán của nó trong bệnh có đột biến SMARCA4.
- Suy luận cơ chế: Các kết quả làm giàu gen và đường dẫn là liên kết; cần các nghiên cứu dựa trên mô có triển vọng và phân loại không gian để xác nhận cơ chế của sự loại trừ miễn dịch.
Tuy nhiên, tín hiệu đáng tin cậy rằng các đột biến đồng thời STK11/KEAP1 xác định một nhóm có kết quả kém trên hóa miễn dịch liệu pháp phù hợp với các tài liệu trước đây liên kết các đột biến này – đặc biệt là trong các khối u có đột biến KRAS – với sự kháng miễn dịch. Dữ liệu này hỗ trợ việc sử dụng các bảng giải trình tự gen toàn diện để xác định các đột biến SMARCA4, KRAS, STK11 và KEAP1 trước khi lựa chọn điều trị.
Ý nghĩa lâm sàng và khuyến nghị
Đối với các bác sĩ lâm sàng và nhóm đa ngành về ngực, những điểm quan trọng nhất là:
- Thực hiện giải trình tự gen toàn diện (NGS) trong NSCLC có thể cắt bỏ và tiến triển để phát hiện SMARCA4 và các đột biến đồng thời (KRAS, STK11, KEAP1) cung cấp thông tin về tiên lượng và khả năng đáp ứng miễn dịch.
- Miễn dịch hóa trị liệu tiền phẫu thuật dường như rất hoạt động trong NSCLC biểu mô vảy có biến đổi SMARCA4 và có thể đạt được tỷ lệ pCR cao; các bệnh nhân biểu mô vảy có mất chức năng SMARCA4 có thể hưởng lợi đặc biệt từ chiến lược này trước khi xác nhận triển khai.
- Trong NSCLC không phải biểu mô vảy có biến đổi SMARCA4, đánh giá ngữ cảnh đột biến đồng thời: KRAS với STK11/KEAP1 đồng biến đổi đánh dấu một nhóm nguy cơ cao, không có tế bào miễn dịch, trong đó hóa miễn dịch liệu pháp tiêu chuẩn thường mang lại lợi ích hạn chế – những bệnh nhân này nên được ưu tiên tham gia các thử nghiệm lâm sàng thử nghiệm các kết hợp mới (ví dụ, các tác nhân điều chỉnh môi trường vi khối u, các cách tiếp cận chuyển hóa mục tiêu, hoặc các kết hợp giải quyết tín hiệu mTOR/MYC).
- Xem xét thêm các hồ sơ miễn dịch (PD-L1, các dấu hiệu miễn dịch biểu hiện gen, phân loại miễn dịch không gian) nếu có sẵn để tinh chỉnh dự đoán lợi ích từ miễn dịch liệu pháp.
Bước tiếp theo cho nghiên cứu
Cần các thử nghiệm triển khai phân tầng theo trạng thái SMARCA4 và các mẫu đột biến đồng thời để xác nhận các quan sát này. Các câu hỏi ưu tiên bao gồm:
- Có thể làm nhạy cảm lại các khối u SMARCA4-mút có môi trường vi miễn dịch lạnh đối với miễn dịch liệu pháp bằng các kết hợp hợp lý (các chất gây ứng đáp STING, các chất điều chỉnh biểu sinh, các chất ức chế đường dẫn chuyển hóa, hoặc các can thiệp trục NRF2/KEAP1) hay không?
- Có sự khác biệt về lợi ích phụ trợ/nguyên phát giữa các lớp đột biến SMARCA4 có thể hướng dẫn cường độ điều trị hay không?
- Các dấu hiệu biểu hiện gen cụ thể hoặc không gian nào tốt nhất để nắm bắt sự loại trừ miễn dịch và dự đoán sự kháng thuốc trong NSCLC có biến đổi SMARCA4?
Kết luận
NSCLC có biến đổi SMARCA4 là đa dạng về mặt lâm sàng và sinh học. Bằng chứng hồi cứu hiện tại cho thấy rằng các khối u biểu mô vảy có biến đổi SMARCA4 rất nhạy cảm với miễn dịch hóa trị liệu tiền phẫu thuật, trong khi các khối u không phải biểu mô vảy – đặc biệt là những khối u mang KRAS cộng với STK11 và/hoặc KEAP1 đồng biến đổi – tạo thành một nhóm nguy cơ cao, không có tế bào miễn dịch, với lợi ích giới hạn từ hóa miễn dịch liệu pháp tiêu chuẩn. Những kết quả này lập luận cho việc sàng lọc gen toàn diện thường xuyên để hướng dẫn quyết định điều trị và ưu tiên các thử nghiệm triển khai nhằm thử nghiệm các chiến lược kết hợp được tùy chỉnh để vượt qua sự kháng miễn dịch trong tập hợp phân tử thách thức này.
Quỹ tài trợ và clinicaltrials.gov
Quỹ tài trợ và đăng ký thử nghiệm lâm sàng: Quỹ tài trợ và các số định danh thử nghiệm lâm sàng riêng biệt đã được báo cáo trong các bài viết gốc (Peng et al., J Thorac Oncol 2025; Dong et al., Transl Lung Cancer Res 2025). Người đọc nên tham khảo các báo cáo đó để biết thông tin chi tiết về lời cảm ơn và thông tin thử nghiệm. Không có thêm các tuyên bố tài trợ trong bản tổng hợp này.
Tham khảo
1. Peng LS, Cui Q, Zhang C, et al. Neoadjuvant Immunochemotherapy in Resectable NSCLC With SMARCA4 Alterations. J Thorac Oncol. 2025 Oct 27. doi:10.1016/j.jtho.2025.10.013 IF: 20.8 Q1 . PMID: 41161592 IF: 20.8 Q1 .
2. Dong Z, Zuo R, Guo Y, et al. STK11/KEAP1 co-mutations in SMARCA4-mutant advanced non-small cell lung cancer: genetic characteristics and impact on immunotherapy efficacy. Transl Lung Cancer Res. 2025 Aug 31;14(8):3024-3041. doi:10.21037/tlcr-2025-305 IF: 3.5 Q1 . PMID: 40948837 IF: 3.5 Q1 ; PMCID: PMC12432681 IF: 3.5 Q1 .
3. The Cancer Genome Atlas Research Network. Comprehensive molecular profiling of lung adenocarcinoma. (TCGA LUAD) — xem các bài viết gốc của TCGA để biết các tập dữ liệu được sử dụng trong phân tích thứ cấp.
Lưu ý: Bài viết này tổng hợp và diễn giải các kết quả đã được công bố. Các bác sĩ nên tham khảo các bài viết gốc để biết chi tiết phương pháp học và các giao thức điều trị của cơ sở.