Nhấn mạnh
– Phân tích FAERS từ 2013 đến 2023 của gần 14 triệu báo cáo đã xác định rằng phơi nhiễm các chất ức chế điểm kiểm soát miễn dịch (ICI) có liên quan độc lập với nguy cơ cao hơn nhiều của hội chứng Stevens-Johnson/toàn thân bong tróc (SJS/TEN) (OR điều chỉnh 9.14; khoảng tin cậy 95% 8.42–9.93).
– Phơi nhiễm đồng thời với các thuốc có nguy cơ cao đã được xác định (ví dụ: allopurinol, sulfonamid) và ICIs cho thấy sự tương tác cộng gộp/hơn cộng gộp (tỷ lệ quy thuộc [AP] 0.38 cho các nguyên nhân mạnh; AP 0.52 cho các nguyên nhân yếu), hỗ trợ mô hình hai lần tấn công.
– SJS/TEN liên quan đến ICI xuất hiện muộn hơn so với các trường hợp không liên quan đến ICI, đặc biệt là với các chất ức chế PD-1, phù hợp với sự kích hoạt miễn dịch kéo dài và thách thức trong chẩn đoán trong chăm sóc ung thư.
Nền tảng
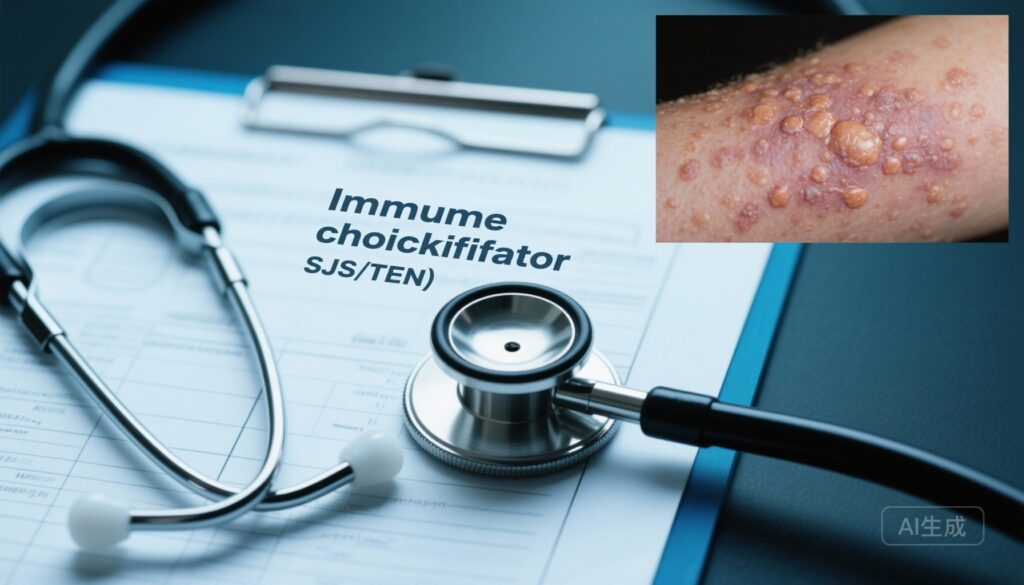
Hội chứng Stevens-Johnson và toàn thân bong tróc (SJS/TEN) là những phản ứng niêm mạc da hiếm gặp, đe dọa tính mạng do phản ứng miễn dịch gây độc tế bào đối với thuốc hoặc nhiễm trùng. Tỷ lệ tử vong vẫn cao trong TEN và người sống sót thường có mức độ rối loạn đáng kể. Các chất ức chế điểm kiểm soát miễn dịch (ICIs) nhắm vào PD-1, PD-L1, CTLA-4 và các đường ức chế khác đã biến đổi ngành ung thư bằng cách giải phóng miễn dịch chống khối u, nhưng chúng cũng gây ra các tác dụng phụ miễn dịch đa dạng (irAEs), bao gồm độc tính da. Việc phân biệt SJS/TEN điển hình, cụ thể về thuốc từ SJS/TEN giống như hoặc phát ban bong bóng dạng sẹo lichen liên quan đến ICI là một thách thức lâm sàng, và sự tương tác giữa ICIs và các chất gây kích ứng thuốc khác chưa được mô tả đầy đủ. Với việc sử dụng ICIs mở rộng trong các loại khối u và các tuyến điều trị, làm rõ vai trò của chúng trong nguy cơ, thời gian và cơ chế của SJS/TEN là nhu cầu lâm sàng cấp bách.
Thiết kế và phương pháp nghiên cứu
Mukherjee và cộng sự đã kiểm tra 13,986,839 báo cáo đã loại bỏ trùng lặp trong Hệ thống Báo cáo Sự cố của Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FAERS) từ 2013 đến 2023 để xác định các báo cáo về SJS/TEN (n=17,495). Các tác giả đã sử dụng hồi quy logistic đa biến để đánh giá mối liên quan giữa phơi nhiễm ICI và SJS/TEN, điều chỉnh theo tuổi (điều khoản spline), giới tính, chẩn đoán ung thư được ghi nhận, dùng nhiều thuốc (số lượng thuốc dùng cùng lúc), và phơi nhiễm với các thuốc nguyên nhân mạnh (ví dụ: lamotrigine; trimethoprim-sulfamethoxazole; phenytoin; allopurinol; carbamazepine) và yếu (một số macrolide, fluoroquinolone, acyclovir). Các chỉ số tương tác — rủi ro dư thừa do tương tác (RERI), tỷ lệ quy thuộc (AP), và chỉ số tương tác — đã lượng hóa rủi ro cộng gộp/hơn cộng gộp khi ICIs xuất hiện cùng với các nguyên nhân khác. Phân tích thời gian khởi phát sử dụng hai mô hình nguy cơ tỷ lệ Cox: (1) mô hình dựa trên cơ chế phân loại chất gây nghi ngờ chính (PS) theo cơ chế ICI, và (2) mô hình phụ thuộc thời gian cập nhật phơi nhiễm động đến các chất ức chế PD-1/PD-L1, CTLA-4, hoặc LAG-3. Các mô hình bao gồm các biến số giống nhau và xử lý tuổi thiếu hụt bằng cách bổ sung. Các chi tiết phân tích thêm được báo cáo trong phương pháp bổ sung.
Kết quả chính
Mối liên quan độc lập với SJS/TEN: Trong phân tích điều chỉnh, các báo cáo có bất kỳ ICI nào được liệt kê có tỷ lệ nguy cơ SJS/TEN cao hơn đáng kể so với các báo cáo không liên quan đến ICI (tỷ lệ tỷ lệ nguy cơ điều chỉnh [aOR] 9.14; khoảng tin cậy 95% 8.42–9.93; P < .001). Như dự kiến, phơi nhiễm với các thuốc nguyên nhân mạnh đã được xác định là dự đoán độc lập mạnh nhất (aOR 14.31; khoảng tin cậy 95% 13.77–14.87). Các nguyên nhân yếu cũng giữ mối liên quan độc lập (aOR 3.69; khoảng tin cậy 95% 3.51–3.88).
Tương tác với các nguyên nhân thuốc khác: Phân tích tương tác chỉ ra hiệu ứng cộng gộp hoặc hơn cộng gộp. Đối với bệnh nhân phơi nhiễm đồng thời với ICIs và các nguyên nhân mạnh, AP là 0.38 (khoảng tin cậy 95% 0.22–0.50), chỉ ra 38% nguy cơ trong số những người phơi nhiễm đồng thời có thể quy thuộc cho sự tương tác. Đối với ICIs với các nguyên nhân yếu, AP cao hơn (0.52; khoảng tin cậy 95% 0.38–0.63), và chỉ số tương tác vượt quá 1 cho cả hai loại, hỗ trợ sự đồng hiện hơn đơn giản là sự nhân gộp. Các giá trị RERI dương và có ý nghĩa thống kê cho cả hai loại, phù hợp với rủi ro dư thừa cộng gộp ngoài các tác dụng độc lập.
Thời gian khởi phát và thời gian: Phân tích thời gian khởi phát cho thấy SJS/TEN liên quan đến ICI có xu hướng xảy ra muộn hơn so với các trường hợp không liên quan đến ICI. Thời gian trung bình đến sự kiện cho các báo cáo chất gây nghi ngờ chính anti-PD-1 là 27 ngày so với 13 ngày cho các nguyên nhân không liên quan đến ICI. Trong mô hình Cox phụ thuộc thời gian, các chất ức chế PD-1 có liên quan với nguy cơ khởi phát sớm thấp hơn (HR 0.82; khoảng tin cậy 95% 0.72–0.94; P = .004), phù hợp với sự khởi phát muộn. Mô hình dựa trên cơ chế cũng cho thấy khởi phát muộn cho các chất ức chế PD-1 so với các thuốc không liên quan đến ICI (HR 0.71; khoảng tin cậy 95% 0.60–0.94; P < .001). Chẩn đoán ung thư bản thân có liên quan nghịch đảo với nguy cơ (aOR 0.60; khoảng tin cậy 95% 0.58–0.63) và khởi phát sớm (HR ≈ 0.78 trong cả hai mô hình), có thể phản ánh độ phức tạp trong việc báo cáo hoặc chẩn đoán trong các nhóm bệnh nhân ung thư.
Các quan sát khác và tín hiệu chất lượng dữ liệu: Một số kết quả phân tích đã làm sáng tỏ các hiện tượng báo cáo: các báo cáo thiếu hoặc bổ sung tuổi có tỷ lệ nguy cơ đáng kể khác biệt; danh mục ‘giới tính không xác định’ cho thấy mối liên quan bất thường cao với SJS/TEN, có thể phản ánh độ hoàn thiện báo cáo khác nhau trong các sự cố nghiêm trọng. Số lượng thuốc dùng cùng lúc tăng lên mỗi đơn vị có aOR ít hơn 1, một hướng không mong đợi có thể phản ánh sự đồng tuyến, ngưỡng báo cáo, hoặc nhiễu do chỉ định.
Giải thích và khả năng cơ chế
Các kết quả này tăng cường tín hiệu rằng ICIs là những yếu tố độc lập làm tăng nguy cơ SJS/TEN và đề xuất chúng có thể tác động cộng gộp với các chất gây kích ứng miễn dịch cụ thể về thuốc. Cơ chế: SJS/TEN điển hình là quá trình gây độc tế bào do tế bào T CD8+ trung gian, trong nhiều trường hợp, phụ thuộc vào việc trình bày kháng nguyên có hạn chế HLA từ các chất dẫn xuất từ thuốc (ví dụ, HLA-B*58:01 và phản ứng da nghiêm trọng do allopurinol). ICIs giảm các điểm kiểm soát ức chế trên tế bào T, hạ thấp ngưỡng kích hoạt và có thể cho phép mở rộng và chức năng tác dụng của các tế bào T cụ thể về thuốc đã tồn tại hoặc mới được khởi tạo. Mô hình này phù hợp với giả thuyết hai lần tấn công: (1) một thuốc có nguy cơ cao cung cấp kích thích kháng nguyên có hạn chế HLA; và (2) một ICI khuếch đại đáp ứng tế bào T gây độc, tăng khả năng bị thương tổn niêm mạc da cấp tính. Việc khởi phát muộn với các chất ức chế PD-1 có thể phản ánh sự kích hoạt tế bào T kéo dài, sự lan truyền kháng nguyên chậm, sự tuyển dụng dần dần các tế bào T ký ức cư trú trong tổ chức, hoặc các động lực miễn dịch khác khác với các dị ứng nhanh chóng do phân tử nhỏ.
Ý nghĩa lâm sàng
Đối với các bác sĩ ung thư, bác sĩ da liễu và các đội ngũ chăm sóc cấp cứu, nghiên cứu mang lại một số điểm hành động:
- Xem xét lại thuốc trước khi điều trị: Xem xét kỹ lưỡng và, nếu có thể, tránh khởi đầu hoặc tiếp tục sử dụng các thuốc có nguy cơ cao (ví dụ: allopurinol, sulfonamid, chống động kinh thơm) gần thời điểm khởi đầu ICI. Đối với các thuốc có liên quan HLA đã biết (ví dụ: allopurinol và HLA-B*58:01), tuân thủ hướng dẫn di truyền học thuốc hiện tại (kiểm tra HLA-B*58:01 ở các nhóm có nguy cơ trước khi bắt đầu allopurinol).
- Tăng cường cảnh giác đối với các phản ứng muộn: Giữ một khoảng thời gian giám sát lâu hơn cho các phản ứng da nghiêm trọng sau khi phơi nhiễm ICI, đặc biệt là với các chất ức chế anti-PD-1. Trong các phòng khám ung thư, giáo dục bệnh nhân và y tá truyền dịch báo cáo các triệu chứng niêm mạc, phát ban, hoặc các tổn thương da lan rộng nhanh chóng ngay cả vài tuần sau khi bắt đầu điều trị.
- Cẩn trọng chẩn đoán và can thiệp chuyên gia sớm: Phân biệt SJS/TEN thực sự từ các phát ban dạng sẹo lichen hoặc bong bóng liên quan đến ICI, vì các chiến lược quản lý và tiên lượng có thể khác nhau. Tham vấn sớm chuyên khoa da liễu và xem xét sinh thiết da, cùng với việc chuyển đến đơn vị bỏng khi cần thiết, vẫn rất quan trọng.
- Quyết định kê đơn đồng thời: Ở nơi có các lựa chọn thay thế (ví dụ: thay thế các chất có nguy cơ thấp hơn cho dự phòng hoặc điều trị nhiễm trùng), cân nhắc tránh các chất fluoroquinolone/macrolide hoặc các chất có liên quan khác đồng thời với ICIs nếu nguy cơ cụ thể của bệnh nhân cho phép.
Điều trị: Quản lý SJS/TEN liên quan đến ICI phù hợp với các nguyên tắc chung của SJS/TEN — ngừng ngay các chất gây nghi ngờ, chăm sóc hỗ trợ, quản lý đa ngành, và xem xét điều trị điều hòa miễn dịch toàn thân. Dữ liệu hạn chế về việc liệu SJS/TEN liên quan đến ức chế điểm kiểm soát có đáp ứng khác biệt với các liệu pháp miễn dịch cụ thể (ví dụ: corticosteroid toàn thân, cyclosporine, IVIG). Phải cân nhắc giữa ức chế miễn dịch và kiểm soát ung thư, nguy cơ nhiễm trùng; quyết định nên cá nhân hóa.
Lợi ích và hạn chế
Lợi ích của nghiên cứu bao gồm dữ liệu giám sát dược phẩm rất lớn, mô hình hóa đa biến cẩn thận, sử dụng các chỉ số tương tác để lượng hóa rủi ro cộng gộp, và mô hình hóa kép thời gian khởi phát (dựa trên cơ chế và phụ thuộc thời gian). Các kết quả là hợp lý về mặt sinh học và nhất quán qua các phương pháp phân tích.
Tuy nhiên, việc diễn giải phải xem xét các hạn chế của FAERS: báo cáo không đầy đủ, chất lượng báo cáo khác nhau, báo cáo kích thích sau các tín hiệu an toàn, thiếu hoặc không chính xác thời gian phơi nhiễm, không thể xác nhận chẩn đoán lâm sàng, thiếu dữ liệu mẫu (tỷ lệ mắc), và nhiễu do chỉ định. Liên quan nghịch đảo của ung thư đã ghi nhận với nguy cơ SJS/TEN có thể phản ánh các mẫu báo cáo hoặc tài liệu thay vì hiệu ứng bảo vệ sinh học. Một số kết quả phân tích (ví dụ: giới tính không xác định, hiệu ứng bảo vệ nhỏ theo thuốc) làm nổi bật các vấn đề về độ hoàn thiện dữ liệu. Không thể xác định chắc chắn mối quan hệ nhân quả trong các báo cáo tự nguyện; cần các nghiên cứu đăng ký và quan sát kiểm soát.
Ưu tiên nghiên cứu và thực hành
Ưu tiên ngay lập tức bao gồm:
- Nghiên cứu giám sát dược phẩm và đăng ký triển vọng thu thập thời gian, liều lượng, chẩn đoán xác nhận bằng sinh thiết, và kết quả chính xác để ước tính tỷ lệ mắc và nguy cơ quy thuộc.
- Nghiên cứu di truyền học thuốc để xác định các dấu hiệu HLA và các yếu tố chủ khác dự đoán SJS/TEN liên quan đến ICI hoặc làm tăng cường sự tương tác với các thuốc cụ thể.
- Nghiên cứu cơ chế dịch chuyển (repertoire thụ thể tế bào T, phân loại tế bào đơn, thử nghiệm trình bày kháng nguyên) để chứng minh liệu ICIs có mở rộng các dòng tế bào T gây độc cụ thể về thuốc hay không hoặc có điều chỉnh các con đường bệnh lý khác.
- Hướng dẫn lâm sàng giải quyết các thực hành kê đơn đồng thời, cửa sổ theo dõi sau khi khởi đầu ICI, và các đường dẫn quản lý chuẩn hóa cho SJS/TEN nghi ngờ liên quan đến ICI.
Kết luận
Phân tích FAERS toàn diện này cung cấp bằng chứng giám sát dược phẩm mạnh mẽ rằng các chất ức chế điểm kiểm soát miễn dịch có liên quan độc lập với việc tăng báo cáo SJS/TEN và rằng phơi nhiễm đồng thời với các thuốc nguyên nhân đã biết đáng kể làm tăng nguy cơ, phù hợp với mô hình hai lần tấn công do tế bào T trung gian. Sự khởi phát muộn với các chất ức chế PD-1 đặt ra thách thức chẩn đoán trong chăm sóc ung thư. Các bác sĩ nên ưu tiên việc xem xét lại thuốc, giáo dục bệnh nhân, và can thiệp sớm của chuyên khoa da liễu, và các nhà nghiên cứu nên theo đuổi các nghiên cứu triển vọng, cơ chế, và di truyền học thuốc để hướng dẫn kê đơn an toàn và phân loại nguy cơ trong kỷ nguyên miễn dịch chống ung thư.
Quỹ tài trợ và đăng ký thử nghiệm
Nghiên cứu chính là phân tích giám sát dược phẩm của dữ liệu FAERS. Không có thông tin tài trợ từ ngành công nghiệp hoặc thử nghiệm lâm sàng trong tóm tắt. Để biết các thông số định danh thử nghiệm hoặc chi tiết tài trợ, tham khảo xuất bản gốc: Mukherjee et al., JAMA Oncology (2025).
Tham khảo
1. Mukherjee M, Park D, Asiaee A, et al. Immune Checkpoint Inhibitors as Independent and Synergistic Drivers of SJS/TEN. JAMA Oncol. 2025 Oct 30. doi:10.1001/jamaoncol.2025.4349. PMID: 41165703.
2. Postow MA, Sidlow R, Hellmann MD. Immune-related adverse events associated with immune checkpoint blockade. N Engl J Med. 2018 Jan 11;378(2):158-168. doi:10.1056/NEJMra1703481.
3. Hung SI, Chung WH, Liou LB, et al. HLA-B*5801 allele as a genetic marker for severe cutaneous adverse reactions caused by allopurinol. N Engl J Med. 2005 Nov 10;353(11):1125-1131. doi:10.1056/NEJMoa051961.
4. Roujeau JC, Stern RS. Severe adverse cutaneous reactions to drugs. N Engl J Med. 1994 Nov 10;331(19):1272-1285. doi:10.1056/NEJM199411103311907.
Hình ảnh AI cho hình thu nhỏ bài viết
Một minh họa chi tiết lâm sàng: một bác sĩ ung thư và bác sĩ da liễu lo lắng đang xem xét hồ sơ bệnh án của bệnh nhân trong phòng khám sáng sủa; ở phía trước là hình ảnh cận cảnh phát ban bong bóng trên cánh tay và danh sách thuốc mở có ghi ‘immune checkpoint inhibitor’ và ‘allopurinol’; tông màu xanh mát và trung tính, thực tế, ánh sáng kịch tính nhẹ, tập trung vào khuôn mặt và phát ban, tỷ lệ 3:2.