Nổi bật
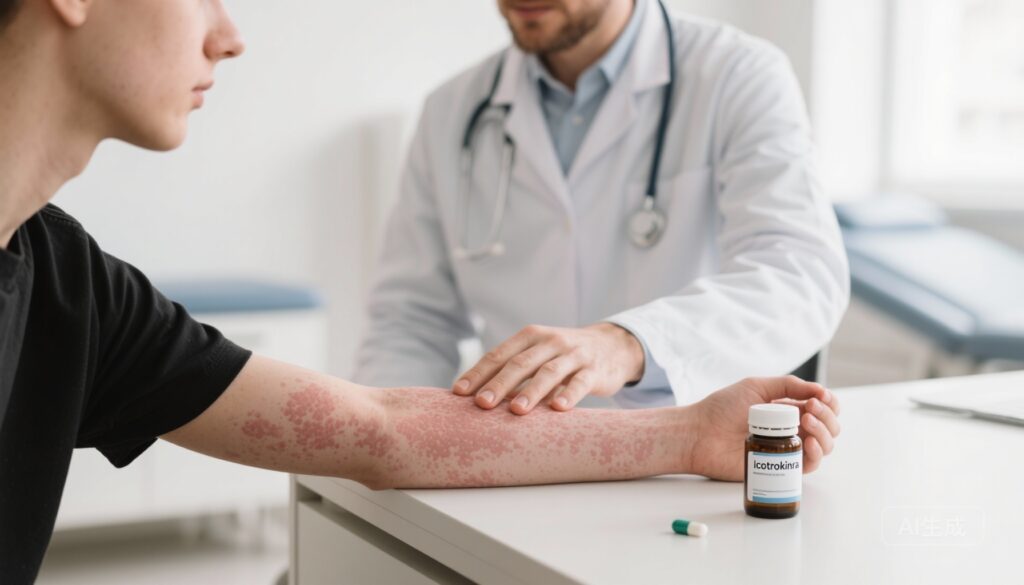
Icotrokinra, một polypeptit đường uống một lần mỗi ngày chọn lọc đối kháng thụ thể interleukin-23 (IL-23R), đã tạo ra sự rõ ràng nhanh chóng và có ý nghĩa lâm sàng trên da ở người lớn và thiếu niên mắc vẩy nến mảng trung bình đến nặng. Các điểm kết thúc chính đã được đáp ứng trong nhiều thử nghiệm giai đoạn 3 (ICONIC và ICONIC-ADVANCE), với tỷ lệ IGA 0/1 khoảng 65–70% và tỷ lệ PASI 90 là 50–57% tại tuần 16. Độ an toàn ngắn hạn trong 16–24 tuần tương đương với giả dược và thuận lợi hơn so với chất ức chế TYK2 đường uống trong phân tích tổng hợp, nhưng cần theo dõi lâu dài để xác định đầy đủ hồ sơ lợi ích-nguy cơ.
Nền tảng và nhu cầu chưa được đáp ứng
Vẩy nến mảng là một bệnh viêm da mãn tính, do hệ miễn dịch gây ra, giảm đáng kể chất lượng cuộc sống và đi kèm với các bệnh đồng mắc toàn thân như viêm khớp vẩy nến, bệnh tim mạch và gánh nặng về sức khỏe tâm thần. Trong thập kỷ qua, các liệu pháp sinh học nhắm mục tiêu vào IL-23 (p19), IL-17 và TNF đã cải thiện đáng kể kết quả, cho phép đạt tỷ lệ rõ ràng cao trên da. Tuy nhiên, các dạng tiêm vẫn là hình thức chủ đạo của các chất hiệu quả nhất, và vẫn có nhu cầu liên tục về các liệu pháp hiệu quả, đường uống có hồ sơ an toàn tốt và tiện lợi cho bệnh nhân. Icotrokinra đại diện cho một cách tiếp cận mới: một polypeptit nhỏ, đường uống được thiết kế để gắn kết chọn lọc với thụ thể IL-23, từ đó chặn tín hiệu IL-23 ở đầu nguồn của các tác nhân Th17 liên quan đến bệnh lý vẩy nến.
Thiết kế nghiên cứu và quần thể
ICONIC-LEAD (báo cáo NEJM)
Thử nghiệm giai đoạn 3 ngẫu nhiên, đối chứng giả dược, mù đôi đã tuyển chọn người lớn và thiếu niên (≥12 tuổi) mắc vẩy nến mảng trung bình đến nặng được xác định bằng diện tích bề mặt cơ thể bị ảnh hưởng ≥10%, PASI cơ bản ≥12 và Đánh giá Toàn diện của Người điều tra (IGA) ≥3. Người tham gia được phân ngẫu nhiên 2:1 để sử dụng icotrokinra đường uống 200 mg một lần mỗi ngày trong 24 tuần hoặc giả dược trong 16 tuần sau đó chuyển sang icotrokinra. Các điểm kết thúc chính là tỷ lệ đạt IGA 0/1 (rõ ràng hoặc gần như rõ ràng, với cải thiện ≥2 điểm) và PASI 90 (giảm ≥90%) tại tuần 16.
ICONIC-ADVANCE 1 và 2 (báo cáo Lancet)
Hai thử nghiệm giai đoạn 3 toàn cầu (ADVANCE 1 và 2) đã phân ngẫu nhiên người lớn có lịch sử mắc vẩy nến ít nhất 26 tuần để sử dụng icotrokinra 200 mg một lần mỗi ngày, giả dược hoặc deucravacitinib 6 mg mỗi ngày (một chất ức chế TYK2 đường uống). Các phương án phân ngẫu nhiên là 2:1:2 (ADVANCE 1) và 4:1:4 (ADVANCE 2). Các nhóm giả dược và deucravacitinib chuyển sang icotrokinra tại các tuần được chỉ định trước (16 hoặc 24). Các điểm kết thúc chính tương tự như ICONIC-LEAD: IGA 0/1 với cải thiện ≥2 mức độ và PASI 90 tại tuần 16. Các thử nghiệm tuyển chọn quần thể đa quốc gia rộng rãi từ nhiều địa điểm và là mù đôi, đối chứng với chất so sánh hoạt tính.
Kết quả hiệu quả chính
ICONIC-LEAD (NEJM)
Trong số 684 người tham gia được phân ngẫu nhiên (456 icotrokinra, 228 giả dược), icotrokinra đã tạo ra tỷ lệ rõ ràng trên da cao hơn đáng kể tại tuần 16:
– IGA 0/1: 65% với icotrokinra so với 8% với giả dược (P<0.001).
– PASI 90: 50% so với 4% (P<0.001).
– Rõ ràng hoàn toàn (IGA 0): 33% so với 1%.
– PASI 100 (rõ ràng hoàn toàn): 27% so với <1%.
Các kích thước hiệu ứng này cho thấy hiệu quả lâm sàng đáng kể trong 16 tuần ở quần thể hỗn hợp người lớn và thiếu niên.
ICONIC-ADVANCE 1 và 2 (Lancet)
Cả hai thử nghiệm ADVANCE đều đạt được các điểm kết thúc chính tại tuần 16. Kết quả đại diện:
– ADVANCE 1: IGA 0/1 ở 68% (311 icotrokinra) so với 11% (156 giả dược); PASI 90 ở 55% so với 4% (cả hai p<0.0001).
– ADVANCE 2: IGA 0/1 ở 70% (322 icotrokinra) so với 9% (82 giả dược); PASI 90 ở 57% so với 1% (cả hai p<0.0001).
Trong cả hai thử nghiệm ADVANCE, icotrokinra đã tạo ra hiệu quả nhất quán và có thể tái hiện được với tỷ lệ IGA 0/1 khoảng hai phần ba bệnh nhân được điều trị và PASI 90 tiếp cận 55–57% tại tuần 16.
Tham chiếu so sánh
Mặc dù không có so sánh trực tiếp về hiệu quả giữa icotrokinra và các kháng thể đơn dòng chống IL-23 p19 đã được thiết lập trong các bài báo này, nhưng mức độ đáp ứng với icotrokinra tiếp cận các mức độ thường thấy với các sinh phẩm hiện đại tại các thời điểm tương tự. Chương trình ICONIC-ADVANCE cũng bao gồm deucravacitinib làm chất so sánh hoạt tính đường uống; dữ liệu an toàn đến tuần 24 cho thấy gánh nặng tác dụng phụ cao hơn một chút với deucravacitinib so với icotrokinra (65% so với 57% đến tuần 24), nhưng so sánh hiệu quả với deucravacitinib không được chi tiết trong tóm tắt cung cấp và nên được giải thích khi các phân tích so sánh đầy đủ có sẵn.
An toàn và dung nạp
Trong các thử nghiệm, tỷ lệ tổng thể của các tác dụng phụ qua tuần 16 là tương tự giữa icotrokinra và giả dược. Trong ICONIC-LEAD, 49% người tham gia trong mỗi nhóm báo cáo ít nhất một tác dụng phụ đến tuần 16. Các tác dụng phụ được báo cáo phổ biến nhất là viêm mũi họng và nhiễm trùng đường hô hấp trên. Tần suất xuất hiện theo phơi nhiễm vẫn ổn định qua tuần 24.
Trong các phân tích tổng hợp ADVANCE, các tác dụng phụ đến tuần 16 xảy ra ở 48% người nhận icotrokinra và 57% người nhận giả dược; các tác dụng phụ phổ biến nhất là viêm mũi họng và nhiễm trùng đường hô hấp trên. Đến tuần 24, ít tác dụng phụ hơn được ghi nhận với icotrokinra (57%) so với deucravacitinib (65%) trong tập dữ liệu tổng hợp.
Không có tín hiệu an toàn bất ngờ nào được báo cáo trong các phân tích ngắn hạn này; tuy nhiên, các xem xét an toàn quan trọng đối với bất kỳ liệu pháp nào điều chỉnh tín hiệu IL-23 bao gồm nguy cơ nhiễm trùng (đặc biệt là nhiễm trùng cơ hội), tác động tiềm năng đối với giám sát khối u và miễn dịch. Dữ liệu theo dõi (tháng đến năm) và giám sát sau khi đưa ra thị trường sẽ cần thiết để xác định các sự kiện hiếm gặp nhưng nghiêm trọng, tác động đối với các bệnh đồng mắc và sự bền vững của đáp ứng.
Bình luận và diễn giải của chuyên gia
Chương trình ICONIC cho thấy rằng việc chặn thụ thể IL-23 bằng đường uống có thể đạt được sự rõ ràng trên da có ý nghĩa lâm sàng và nhanh chóng trong một quần thể vẩy nến lớn, đa dạng, bao gồm cả thiếu niên. Điểm mạnh của các chương trình này bao gồm thiết kế ngẫu nhiên, mù đôi; kích thước mẫu lớn; các điểm kết thúc chính nhất quán được sử dụng trong các thử nghiệm; và bao gồm chất so sánh hoạt tính đường uống trong các thử nghiệm ADVANCE.
Về mặt cơ chế, IL-23 là một cytokine trung tâm trong đường dẫn truyền Th17 và là mục tiêu điều trị được xác nhận trong vẩy nến. Khác với các kháng thể đơn dòng chống subunit IL-23 p19, icotrokinra gắn kết với thụ thể IL-23, một nút khác trong cùng một đường dẫn truyền. Định dạng polypeptit đường uống có thể cải thiện sự tiện lợi và khả năng chấp nhận của bệnh nhân, đặc biệt là đối với những người không thích tiêm.
Những điểm cần lưu ý khi diễn giải bao gồm điểm kết thúc chính tương đối ngắn (tuần 16) cho việc quản lý bệnh mãn tính dài hạn, thiết kế chuyển đổi giả dược giới hạn so sánh giả dược dài hạn, và tiết lộ hạn chế trong các tóm tắt về hiệu quả so với chất so sánh hoạt tính deucravacitinib. Ngoài ra, đánh giá an toàn vượt quá 24 tuần là cần thiết để đánh giá các rủi ro bao gồm nhiễm trùng nghiêm trọng, ung thư, bất thường xét nghiệm và các biến cố miễn dịch hiếm gặp.
Nghĩa vụ lâm sàng và nghiên cứu
Đối với các bác sĩ, icotrokinra có thể sớm cung cấp một lựa chọn đường uống với hiệu quả tương đương với các sinh phẩm hiện đại cho nhiều bệnh nhân mắc vẩy nến mảng trung bình đến nặng. Vai trò của nó so với các chất tiêm đã được thiết lập sẽ phụ thuộc vào hiệu quả bền vững dài hạn, độ an toàn, sở thích của bệnh nhân, chi phí và khả năng tiếp cận, và các thử nghiệm so sánh hiệu quả. Các câu hỏi quan trọng chưa được trả lời bao gồm:
– Sự bền vững của các đáp ứng PASI 90/PASI 100 sau 6–12 tháng.
– Độ an toàn dài hạn, bao gồm nhiễm trùng nghiêm trọng, ung thư và các biến cố tim mạch.
– Hiệu suất trong các nhóm phụ (ví dụ, những người mắc viêm khớp vẩy nến, béo phì, thất bại sinh phẩm trước đó, lao tiềm ẩn).
– So sánh hiệu quả và hiệu quả kinh tế so với các chất ức chế IL-23 p19 tiêm và chất ức chế TYK2 đường uống.
Dữ liệu giai đoạn 3 mở rộng thêm và bằng chứng thực tế sẽ rất quan trọng để trả lời các câu hỏi này.
Hạn chế của bằng chứng hiện tại
Dữ liệu được báo cáo là mạnh mẽ cho điểm kết thúc chính 16 tuần, nhưng các hạn chế chính là thời gian theo dõi ngắn cho các kết quả bệnh mãn tính và chi tiết công khai tương đối hạn chế về các phân tích nhóm phụ nhất định và so sánh với liệu pháp đường uống hoạt tính. Quần thể thử nghiệm thường loại trừ những bệnh nhân có các bệnh đồng mắc đáng kể hoặc nhiễm trùng nghiêm trọng gần đây, điều này có thể hạn chế tính tổng quát. Cuối cùng, mặc dù các so sánh an toàn tổng hợp đến 24 tuần là đáng tin cậy, nhưng theo dõi dài hạn là cần thiết để đánh giá các sự kiện không mong muốn hiếm gặp.
Kết luận
Icotrokinra là một chất đối kháng thụ thể IL-23 đường uống sáng tạo đã tạo ra sự rõ ràng nhanh chóng và đáng kể trên da trong các thử nghiệm giai đoạn 3 của người lớn và thiếu niên mắc vẩy nến mảng trung bình đến nặng. Các điểm kết thúc chính được đáp ứng nhất quán trong các thử nghiệm đa quốc gia quy mô lớn, và độ an toàn ngắn hạn rộng rãi tương đương với giả dược và thuận lợi trong các so sánh tổng hợp với chất ức chế TYK2 đường uống. Dữ liệu này hỗ trợ icotrokinra là một lựa chọn điều trị đường uống hứa hẹn; tuy nhiên, các bác sĩ nên chờ đợi dữ liệu hiệu quả và độ an toàn dài hạn, phân tích so sánh trực tiếp và kinh nghiệm thực tế để xác định đầy đủ vị trí của nó trong thuật toán điều trị.
Quỹ tài trợ và ClinicalTrials.gov
Chương trình ICONIC và ICONIC-ADVANCE được tài trợ bởi Johnson & Johnson. Đăng ký thử nghiệm lâm sàng bao gồm NCT06095115 (ICONIC-LEAD), NCT06143878 (ICONIC-ADVANCE 1) và NCT06220604 (ICONIC-ADVANCE 2).
Tài liệu tham khảo
Bissonnette R, Soung J, Hebert AA, et al. Oral Icotrokinra for Plaque Psoriasis in Adults and Adolescents. N Engl J Med. 2025 Nov 6;393(18):1784-1795. doi: 10.1056/NEJMoa2504187. PMID: 41191940.
Gold LS, Armstrong AW, Bissonnette R, et al. Once-daily oral icotrokinra versus placebo and once-daily oral deucravacitinib in participants with moderate-to-severe plaque psoriasis (ICONIC-ADVANCE 1 & 2): two phase 3, randomised, placebo-controlled and active-comparator-controlled trials. Lancet. 2025 Sep 27;406(10510):1363-1374. doi: 10.1016/S0140-6736(25)01576-4. PMID: 40976249.