序論
心筋炎と心膜炎は、それぞれ心筋と心膜に影響を与える炎症性疾患です。若年者でよく認識されますが、疫学データではすべての年齢層での発生が確認されています。これらの疾患には、ウイルス感染、免疫介在性炎症性疾患(IMIDs)、悪性腫瘍関連因子など、多様な原因があります。しかし、多くの症例は特発性です。未定義の潜在能力を持つクローン性造血(CHIP)は、白血病関連変異を有する造血幹細胞の年齢関連性拡大を反映し、明らかな悪性腫瘍なしで進行します。DNMT3AおよびTET2遺伝子を頻繁に含むCHIPは、炎症性経路を通じて心血管疾患に寄与しますが、炎症性心疾患との関連はまだ十分に研究されていません。
研究デザインと方法
この観察コホート研究では、UKバイオバンクのデータを解析し、約56歳の平均年齢で心血管または血液学的悪性腫瘍がない335,426人の参加者を登録しました。全エキソーム配列解析データが利用可能でした。CHIP露出は、変異アレル頻度(VAF)≥2%の任意のクローンとVAF ≥10%の大きなクローンを含み、二次的にはDNMT3AおよびTET2変異に焦点を当てました。主要アウトカムは、診断コードによって識別された心筋炎または心膜炎の発症であり、中央値13.6年の追跡期間を対象としました。多変量コックス回帰モデルを使用して、人口統計学的特性と心血管リスク要因を調整して関連性を検討しました。二次分析では、心筋炎と心膜炎を個別に検討し、他の心血管疾患やIMIDsとの比較を行いました。
主要な知見
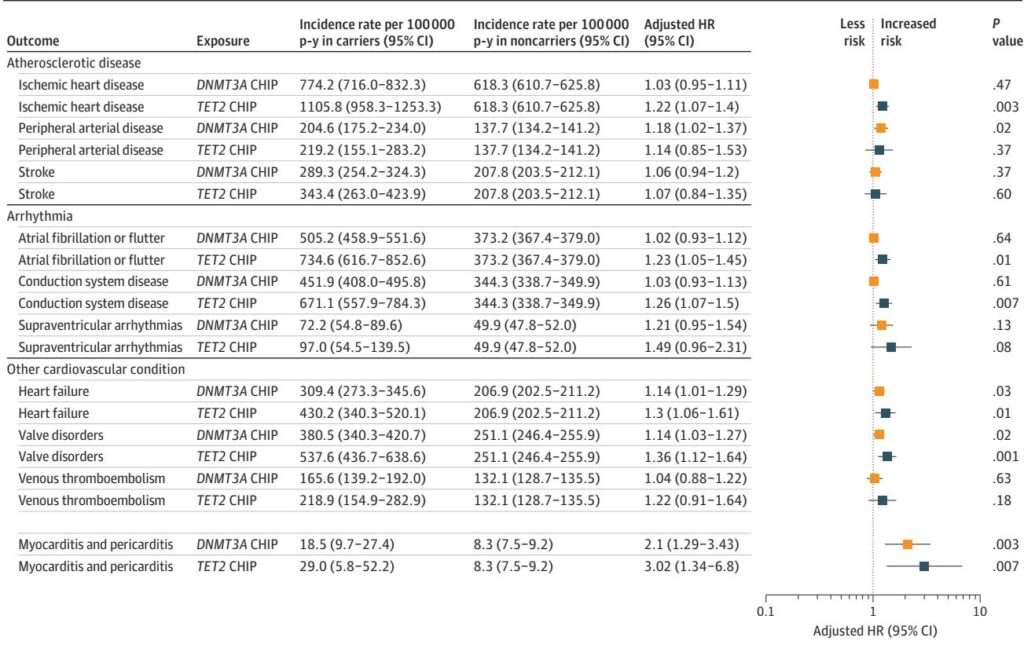
参加者のうち3.3%が任意のCHIPを有し、2.2%が大きなクローンを有していました。追跡期間中、382人が心筋炎または心膜炎を発症しました。任意のCHIPの存在は、複合アウトカムに対する1.75倍のリスク増加(95% CI, 1.14–2.68; P=0.01)を示し、大きなCHIPは2.07倍のリスク増加(95% CI, 1.28–3.33; P=0.003)を示しました。
遺伝子特異的解析では、DNMT3A変異が心膜炎のリスクと強く相関していた(HR 2.22; 95% CI, 1.17–4.21)ことが判明し、TET2変異が心筋炎と相関していた(HR 3.65; 95% CI, 1.16–11.49)。これらの関連性は、冠動脈疾患や心不全などの確立されたCHIP関連心血管疾患で観察されたものよりも強かったです。また、CHIPは非心臓IMIDs(HR 1.27; 95% CI, 1.16–1.39)のリスクも若干高めることを示しました。ただし、仲介解析ではこれらの疾患がCHIP-心筋炎/心膜炎関連の1%未満を説明していることが示されました。
感度解析は一貫してこれらの知見を支持し、癌歴、心血管イベント、異なるアウトカム定義を調整しました。VAFとドライバー変異数の増加に伴うリスクの増加が観察されました。
メカニズム的洞察と臨床的意義
実験モデルでは、特にDNMT3AとTET2変異がNLRP3インフラマソームの活性化と下流サイトカインIL-1βとIL-6の放出による心臓炎症を媒介することが示されています。これらの炎症性経路は、心筋炎と心膜炎の病態生理に貢献しており、難治性症例や再発性心膜炎におけるIL-1ブロック療法の臨床反応により支持されています。
したがって、CHIPは従来のリスク要因を超えて炎症性心疾患を駆動する可能性のある新しいメカニズムを表しています。IL-1阻害を含む標的抗炎症アプローチは、特にCHIPキャリアにおいて有望な治療戦略となる可能性があります。
制限点
本研究は全エキソーム配列解析に依存しているため、特に低VAFクローンのCHIPの頻度を過小評価する可能性があります。参加者の大部分が白人であるため、一般化の限界があります。心筋炎と心膜炎の希少性により、DNMT3AとTET2以外の詳細なサブグループおよび遺伝子特異的解析の力が制限されました。CHIPは基線時のみ評価され、新規クローン拡大の検出は不可能でした。包括的な調整にもかかわらず、残存混雑は完全に排除できません。アウトカム分類が行政コードに基づいているため、誤分類バイアスが導入される可能性があります。
結論
大規模な集団ベースのコホートにおいて、クローン性造血は新規発症の心筋炎および心膜炎の重要な独立リスク因子であることが明らかになりました。特にDNMT3AとTET2変異、大きなクローンサイズでの関連性が最も強かったです。これらの知見は、体細胞造血変異が炎症性心疾患に寄与する役割を示し、CHIPとその炎症性経路が予防と治療戦略の潜在的な標的であることを示唆しています。心筋炎と心膜炎のCHIP駆動型炎症の治療的調節に関するさらなるメカニズム的および臨床試験が必要です。