亮点
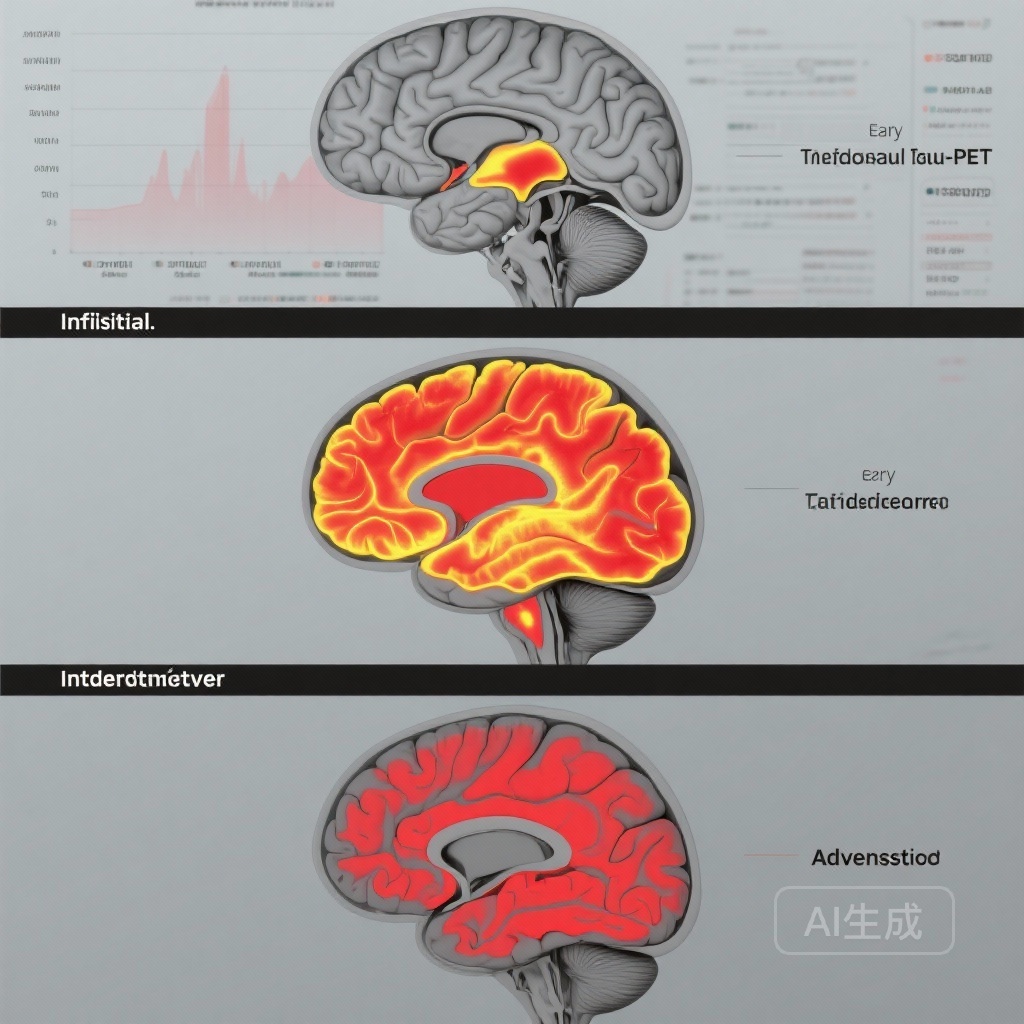
– 纵向tau-PET积累具有阶段依赖性:A+T2-(初始)阶段变化最小,早期阶段局部增加,中间和晚期阶段逐渐广泛积累。
– 基线生物AD分期(A+/T分期)预测了两个独立队列(TRIAD和ADNI)中后续tau扩散的区域分布和程度。
– 选择与疾病阶段匹配的结果感兴趣区域(ROIs)可将假设的疾病修饰效应所需的试验样本量减少30%至93%。
背景
阿尔茨海默病(AD)越来越多地被概念化为由体内淀粉样蛋白-β(A)和tau(T)病理及神经退行(N)的生物标志物定义的连续体,而不仅仅是临床症状。NIA-AA研究框架正式化了这种方法,使试验能够根据生物标志物定义的疾病阶段招募和分层参与者,并选择反映靶标生物学和阶段特异性病理的生物标志物结果(Jack等,2018)。Tau正电子发射断层扫描(tau-PET)现在广泛用于生物分期和作为抗tau或抗淀粉样蛋白干预的候选药效学结果。然而,尚未在大型、特征良好的队列中充分量化生物AD各阶段的纵向tau-PET积累模式以及这些模式如何指导ROI选择和样本量规划。
研究设计
Trudel等人对来自两个观察性队列的参与者进行了回顾性纵向分析:转化衰老和痴呆生物标志物(TRIAD)研究和阿尔茨海默病神经影像学倡议(ADNI)。参与者接受了基线淀粉样蛋白-PET和tau-PET成像,并随访了约3年(±1.35年)。生物AD分期应用于淀粉样蛋白阳性的个体,使用基于tau-PET的分类法:A+T2-(初始),A+T2MTL+(早期;内侧颞叶tau),A+T2MOD+(中间期;更广泛的颞顶叶受累),和A+T2HIGH+(晚期;广泛的皮质tau)。淀粉样蛋白-PET阴性的参与者作为非AD对照组。主要分析使用线性混合效应模型估计各阶段的纵向区域tau-PET变化。次要分析包括统计功效和样本量模拟,以估计当ROI与基线阶段对齐时检测假设的疾病修饰效应所需的参与者数量。
关键发现
人群:汇总分析包括542名参与者(平均年龄67.9±15.3岁,56.3%为女性),其中321名为非AD对照组,221名为生物标志物定义的AD病例。
阶段决定tau积累的分布和速率
主要发现是基线tau阶段预测了tau-PET信号随时间增加的位置和速度。具体来说:
- A+T2-(初始)个体在4-6年内没有明显的纵向tau积累,表明在淀粉样蛋白阳性但tau阴性的人群中,PET可检测到的tau扩散前有一个长时间的潜伏期。
- 早期阶段(A+T2MTL+)参与者表现出局限于早期受影响区域的tau积累(TRIAD:β = 0.15,95% CI 0.09–0.21,p < 0.001;ADNI:β = 0.21,95% CI 0.03–0.40,p = 0.03),与边缘和内侧颞结构的逐步受累一致。
- 中间阶段(A+T2MOD+)参与者在中间分布区域显示出积累(TRIAD:β = 0.16,95% CI 0.10–0.22,p < 0.001;ADNI:β = 0.37,95% CI 0.15–0.59,p = 0.001),表明超过内侧颞叶的颞顶叶扩散。
- 晚期阶段(A+T2HIGH+)参与者在后来受影响的新皮质区域表现出最大且最广泛的增加(TRIAD:β = 0.45,95% CI 0.39–0.50,p < 0.001;ADNI:β = 0.31,95% CI 0.14–0.49,p < 0.001)。
对ROI选择和试验效率的影响
统计功效模拟显示,选择与阶段相匹配的tau-PET ROI(即聚焦于预期会积累tau的区域)显著减少了检测假设的疾病修饰效应所需的样本量。报告的减少范围从30%到93%不等,取决于阶段和队列。最大的收益发生在使用晚期阶段ROI的人群中,这些人群已经表现出广泛的基线tau——在这种情况下,基线信号和动态范围都是最大的。
队列间的可重复性
尽管在示踪剂、采集协议和参与者人口统计学方面存在差异,但TRIAD和ADNI两个独立队列中的发现是一致的,支持了阶段依赖性tau动力学的普遍性。作者指出,示踪剂异质性和队列组成仍然是跨研究协调的关键限制。
专家评论
这些结果验证了一个AD试验的实际原则:将参与者选择和结果测量与主导生物学对齐。对于针对tau的治疗药物,招募具有适当tau阶段的参与者至关重要。在早期或前tau阶段(A+T2-),依赖于tau-PET变化作为主要结果的试验可能因数年内几乎没有PET可检测的变化而缺乏效能。相反,具有中间或晚期tau阶段的参与者提供了可测量的纵向变化和更大的统计信号,但他们可能对下游神经退行已建立的情况下的疾病修饰干预不太敏感。
从机制角度来看,这里观察到的阶段依赖性tau传播与Braak分期的神经病理学相符,tau病理首先出现在transentorhinal/entorhinal皮质,然后扩散到边缘和新皮质区域(Braak & Braak, 1991)。基于PET的分期将这种神经病理学级联在体内操作化,从而实现有针对性的试验设计。
需要考虑的局限性:该研究是回顾性和观察性的,因此无法进行关于治疗调节的因果推断。不同队列之间PET示踪剂、图像处理、人口统计学组成和随访持续时间的差异可能会引入效应估计的异质性。最后,tau-PET量化有技术上的注意事项(某些配体的脱靶结合、部分体积效应)可能影响变化的敏感性。
临床和试验设计的影响
对于计划疾病修饰试验的赞助者和研究者,实际收获包括:
- 在筛选时使用生物标志物分期(A/T框架),确保入组参与者的tau负担和预期动态范围适合所选结果。避免在A+T2-人群中依赖tau-PET作为纵向结果,除非预期效应大小较大或随访时间很长。
- 选择与基线阶段对齐的ROI(例如,早期阶段参与者的内侧颞ROI,中间/晚期阶段的颞顶叶或全脑新皮质ROI),以最大限度地提高功效并减少样本量和成本。
- 在针对早期阶段时,考虑结合生物标志物结果(tau-PET加液体标志物或结构性MRI),以捕捉在PET可检测到tau积累之前可能发生变化的互补信号。
- 尽可能在各站点预指定统一的成像协议和示踪剂使用,以减少测量异质性;当需要多种示踪剂时,应用经过验证的跨示踪剂标准化方法。
结论
Trudel等人提供了强有力的纵向证据,证明tau-PET积累在生物定义的AD中具有强烈的阶段依赖性。基线A/T分期预测了后续tau扩散的区域模式和速率,将结果ROI与疾病阶段对齐可以实质性地提高试验效率。这些发现支持在试验筛选期间常规应用生物分期,并在AD治疗开发中仔细、阶段匹配地选择成像终点。
资金来源和clinicaltrials.gov
主要资金和支持细节报告在原始文章(Trudel等,Neurology 2025)。ADNI是一个公私合作伙伴关系,由多个NIH拨款和行业贡献者支持;TRIAD获得机构和拨款支持,详情见队列文档。本回顾性观察分析不适用clinicaltrials.gov标识符。
参考文献
Trudel L, Therriault J, Macedo AC, Servaes S, Hosseini SA, Bezgin G, Aumont E, Rahmouni N, Fernandez Arias J, Zheng Y, Wang YT, Chan T, Hall BJ, Hopewell R, Hsiao CH, Ferreira PCL, Bellaver B, Vitali P, Soucy JP, Pascoal TA, Gauthier S, Rosa-Neto P; 阿尔茨海默病神经影像学倡议. 生物阿尔茨海默病各阶段纵向tau-PET积累对临床试验的影响. Neurology. 2025 Oct 21;105(8):e214111. doi: 10.1212/WNL.0000000000214111. PMID: 40986433; PMCID: PMC12459282.
Jack CR Jr, Bennett DA, Blennow K, Carrillo MC, Dunn B, Haeberlein SB, Holtzman DM, Jagust W, Jessen F, Karlawish J, 等. NIA-AA研究框架:朝着阿尔茨海默病的生物定义迈进. Alzheimers Dement. 2018 Apr;14(4):535-562. doi: 10.1016/j.jalz.2018.02.018.
Braak H, Braak E. 阿尔茨海默病相关改变的神经病理学分期. Acta Neuropathol. 1991;82(4):239–259. doi:10.1007/BF00308809.