亮点
关键点
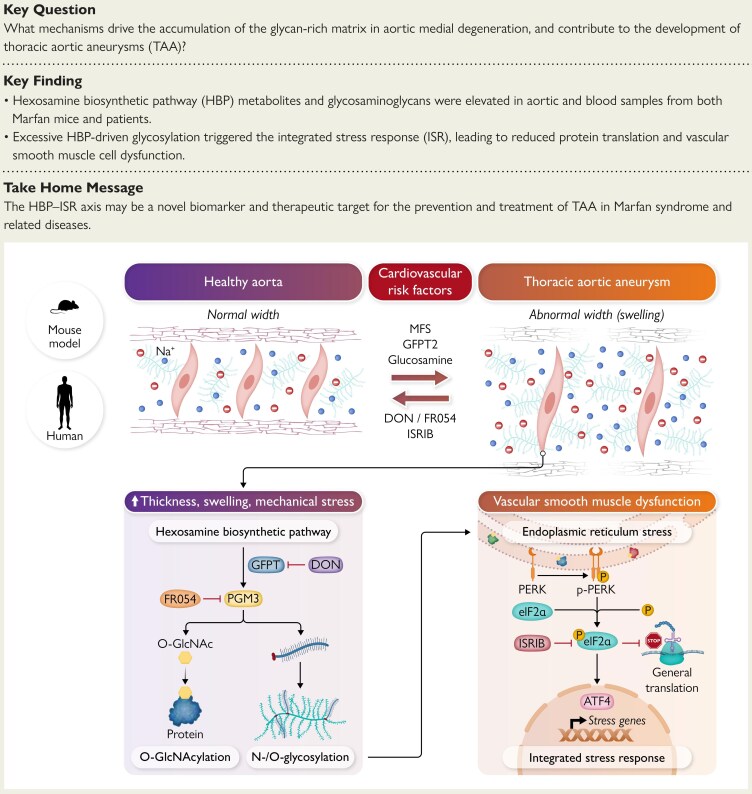
– 多种实验模型和人体主动脉样本显示,在胸主动脉瘤和夹层(TAAD)中,己糖胺生物合成途径(HBP)上调且糖基化增加。
– HBP激活促进血管平滑肌细胞(VSMC)功能障碍并启动整合应激反应(ISR),导致中膜退变和主动脉扩张。
– 药物抑制HBP或ISR可逆转马凡综合征小鼠模型中的分子、细胞和影像学疾病特征,确定了遗传性和散发性TAAD的潜在治疗轴。
背景和疾病负担
主动脉瘤和夹层(TAADs)是威胁生命的主动脉壁结构性疾病,其特征是进行性中膜退变、细胞外基质重塑和功能性血管平滑肌细胞丢失。TAADs既可发生于遗传性结缔组织疾病,最著名的是由FBN1突变引起的马凡综合征,也可发生于与年龄、高血压和未知多因素相关的散发性疾病。由于大多数患者没有可靠的药物疗法来阻止疾病进展,因此目前的管理主要依赖于手术治疗即将发生或已确诊的动脉瘤。因此,识别在遗传性和非遗传性TAAD中均起作用的可调节分子驱动因素是一项迫切未满足的需求。
研究设计和方法
Rochano-Ortiz等人采用了一种综合性的转化方法,结合临床前模型和人体组织分析,测试糖基合成代谢变化是否促进TAAD。作者使用转录组学和代谢组学检查了三种情况下的HBP激活:一种已建立的马凡综合征(MFS)小鼠模型、一种由β-氨基丙腈(BAPN;一种诱导中膜退变的赖氨酰氧化酶抑制剂)诱导的非遗传性TAAD模型,以及来自散发性TAAD患者和MFS患者的主动脉组织。
关键实验读数包括超声心动图评估扩张、组织病理学量化中膜退变和糖基质积累、VSMC功能检测和分子谱型检测HBP代谢物和ISR激活。为了评估因果关系和治疗潜力,作者在MFS小鼠模型中应用了HBP活性和ISR的药物抑制剂,并评估了结构和分子终点。
关键发现
中心观察结果是在所有模型和人类患者中,病变主动脉中HBP的一致性上调。具体发现包括:
- 转录组特征表明,在MFS和BAPN模型以及人类TAAD样本中,HBP酶表达增加。
- 代谢组证据显示HBP通量升高,表现为UDP-GlcNAc等通路代谢物水平增加,这与增强的细胞糖基化潜力一致。
- 中膜层内糖基质丰富的细胞外基质成分组织学累积,与VSMC表型改变和丢失的标志物重合。
- 整合应激反应的激活,表现为典型ISR效应器的上调。ISR是一种保守的细胞程序,响应蛋白质稳定性和代谢应激,可以改变基因表达和蛋白质合成以管理损伤,但在慢性激活时可能促进适应不良重塑。
- 体外和离体分析表明,HBP高活性诱导了适应不良的VSMC行为,包括收缩标志物表达改变、合成表型特征增加和对压力的抵抗力下降。
- 最重要的是,针对HBP或ISR的药物抑制在MFS小鼠模型中产生了可测量的好处:超声心动图显示主动脉扩张减少,组织病理学显示中膜结构改善,VSMC标志物正常化,ISR信号减少。
这些结果共同支持了一个机制序列,其中过量的HBP通量增加了蛋白质糖基化和细胞外糖基沉积,触发了包括ISR在内的细胞应激途径,从而驱动VSMC功能障碍和中膜退变,最终形成动脉瘤。
临床和转化意义
这些数据将注意力转向代谢和翻译后修饰途径作为主动脉疾病的驱动因素。有以下几个影响:
- HBP和ISR代表了多种上游损伤可能导致中膜退变的汇聚节点。HBP–ISR轴在遗传性MFS和散发性人类TAAD样本中均活跃,这提示可能存在一个共享的、可靶向的疾病机制。
- 代谢或应激反应的药物靶向可能补充当前的风险因素管理,并可能减缓尚未需要手术的患者的疾病进展。候选药物包括HBP通量的小分子抑制剂和ISR调节剂。然而,这些药物大多处于实验阶段,尚未证明在TAAD患者中安全有效。
- 未来疗法可能需要组织靶向以避免全身毒性,因为HBP和ISR在多个器官和生理反应中具有基本作用。HBP活性的生物标志物,如组织或循环UDP-GlcNAc水平或蛋白质O-糖基化测量,可以促进患者选择和药效学监测。
专家评论和机制考虑
该研究的优势包括使用互补的疾病模型、整合人体组织数据以及结合转录组学和代谢组学方法,提供了HBP激活的趋同证据。证明药物阻断可逆转遗传模型中的疾病特征加强了因果关系和治疗潜力的论据。
重要的机制要点和限制包括:
- 糖基化的生物学。HBP产生UDP-GlcNAc,这是多种糖基化反应的供体,包括O-糖基化、分泌蛋白的N-糖基化和糖胺聚糖合成。这些修饰影响细胞内信号传导、细胞外基质组成和内质网中的蛋白质折叠,任何这些都可能合理地改变VSMC功能和基质完整性。
- ISR激活可能是由糖基化改变或错误折叠蛋白累积引起的内质网应激下游。ISR在急性应激中具有适应性作用,但当长期激活时可能变得适应不良。因此,靶向ISR需要谨慎,因为它可能会干扰保护性应激反应。
- 药理学和脱靶效应。抑制HBP酶或调节ISR信号的小分子尚未获得慢性心血管用途的许可。许多HBP抑制剂广泛影响氨基酸代谢,而ISR调节剂可以改变全球蛋白质合成。长期安全性、剂量选择和递送至主动脉壁仍然是未解决的问题。
- 从模型到人类的转化。小鼠模型,包括再现马凡特征的Fbn1突变小鼠和BAPN诱导的动脉瘤,是有价值的但不完美。人类TAAD是异质的。在患者样本中存在HBP激活令人鼓舞,但需要前瞻性临床数据将其活动与临床进展或干预反应联系起来。
前进方向:研究和临床开发重点
为了将这些发现转化为临床影响,需要采取几个步骤:
- 在具有纵向采样的额外人类队列中复制和扩展,以测试HBP/ISR标志物是否预测动脉瘤生长或夹层风险。
- 改进药理策略,包括鉴定或开发具有有利特异性和安全性的药物,以及减少系统暴露的局部递送策略。
- 进行预临床慢性给药研究,评估安全性、血管选择性和对血压、伤口愈合、感染风险和其他ISR依赖过程的影响。
- 在经过良好表型分类的患者群体中进行早期临床试验,例如遗传确认的马凡综合征患者和可测量的进行性胸主动脉扩张,使用成像和生物标志物终点评估目标参与和生物活性,然后进行大规模结局试验。
- 调查与已建立的主动脉疾病医疗疗法的潜在相互作用,包括β-阻滞剂、血管紧张素受体阻滞剂和血压控制策略。
结论
Rochano-Ortiz等人的研究表明,己糖胺生物合成途径和整合应激反应是驱动胸主动脉瘤中膜退变的机制轴,无论是在遗传还是非遗传背景下。该工作推进了一种挑衅性的模型,即过度糖基化扰乱了VSMC稳态和细胞外基质组成,启动了保守的应激途径,最终导致动脉瘤形成。通过抑制HBP或ISR在临床前逆转疾病特征支持了这样一个概念,即代谢和蛋白质稳定性信号是可操作的疾病节点。要将这些发现转化为临床实践,需要仔细的药理开发、基于生物标志物的临床研究,并注意安全问题,因为这些途径在正常生理中发挥着核心作用。
资助和clinicaltrials.gov
截至引用文献发表时,尚未在clinicaltrials.gov上注册针对TAAD的HBP或ISR的临床试验。引用的研究报告了支持未来试验开发的临床前和人体组织数据。任何临床开发计划都必须包括对糖基化和应激信号系统作用的严格安全性评估。
参考文献
1. Rochano-Ortiz A, San Sebastián-Jaraba I, Zamora C, Simó C, García-Cañas V, Martínez-Albaladejo S, Fernández-Gómez MJ, et al. Excessive glycosylation drives thoracic aortic aneurysm formation through integrated stress response. Eur Heart J. 2025 Dec 1;46(45):4988-5005. doi: 10.1093/eurheartj/ehaf556 IF: 35.6 Q1 . PMID: 40720766 IF: 35.6 Q1 ; PMCID: PMC12665370 IF: 35.6 Q1 .
2. Loeys BL, Dietz HC, Braverman AC, Callewaert BL, De Backer J, Devereux RB, et al. The revised Ghent nosology for the Marfan syndrome. J Med Genet. 2010 Jul;47(7):476-85.
注:关于HBP、蛋白质O-糖基化和ISR生物学的其他基础文献非常丰富,在设计转化研究时应予以咨询。列出的参考文献集中在主要的转化报告和马凡综合征的临床背景。