引言与背景
胃癌仍然是全球癌症死亡的主要原因之一,尤其集中在东亚、南美部分地区和中亚。2025年,《第二台北全球共识》(Gut 2025;Liou等)重新评估了筛查和根除幽门螺杆菌是否应作为主要预防策略。此次更新回应了自首次台北声明(2020年)以来的重大新证据,包括两项非常大的社区试验(JAMA 2024;Nat Med 2024)、根除疗法的进步(铋剂四联疗法和钾竞争性酸阻滞剂[PCAB]基方案),以及关于长期安全性的新数据(微生物组、抗菌素耐药性和食管结局)。
本文综合了《台北全球共识II》的核心建议和证据,强调了与先前指导相比的变化,并将共识转化为临床医生、公共卫生规划者和研究人员的实用方法。
新指南亮点
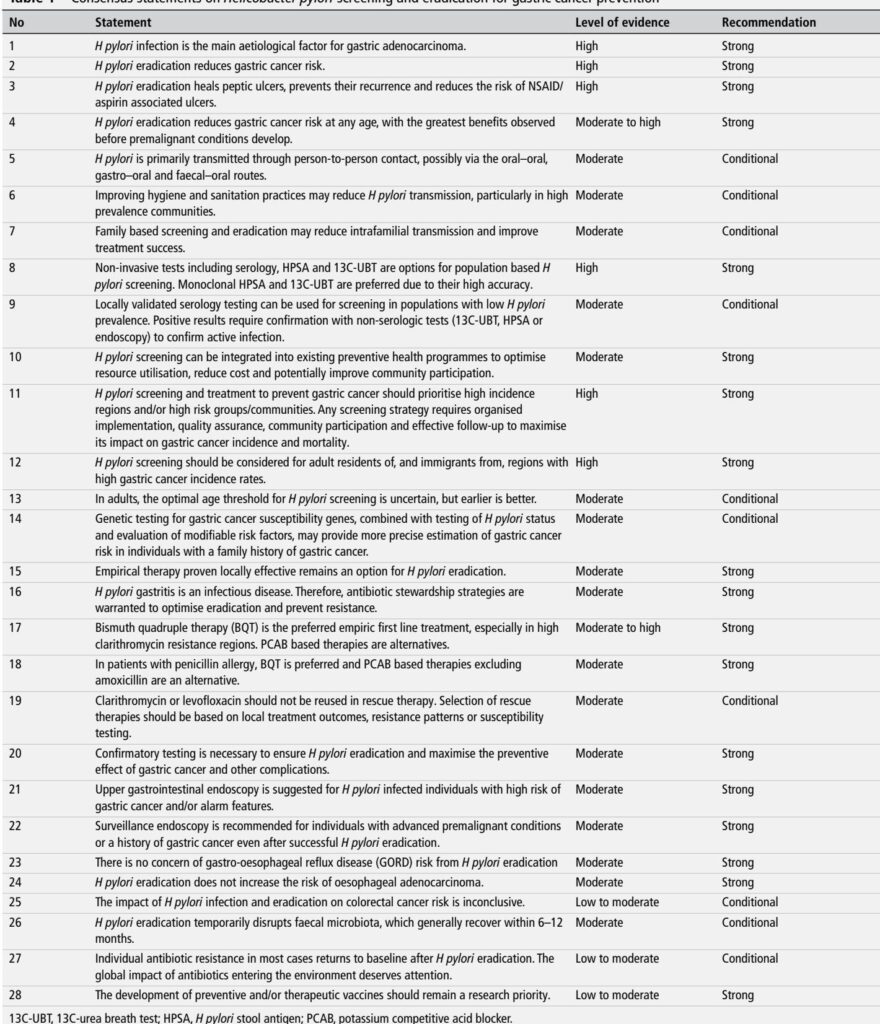
– 共识范围:来自12个国家的32位专家;通过德尔菲过程产生了28项共识声明(Liou JM等,Gut 2025)。
– 总体结论:根除幽门螺杆菌可降低胃癌风险,应提供给所有感染的成年人,尤其是未发生癌前病变时效果最佳(强烈推荐,证据等级高至中等)。
– 筛查重点:优先考虑高发地区和高危群体(来自高胃癌发病率地区的居民和移民)。
– 诊断:人口筛查首选非侵入性检测——13C尿素呼气试验(13C-UBT)和单克隆粪便抗原(HPSA)是首选检测方法;在低流行率地区,经当地验证的血清学检测可用于筛查,但阳性结果需通过非血清学检测确认。
– 治疗:当证明在当地有效时,经验治疗仍可接受。铋剂四联疗法(BQT)是首选的经验一线方案,特别是在克拉霉素耐药率中等至高的地区;PCAB基方案(如伏诺拉生)基方案(特别是伏诺拉生-阿莫西林双联疗法)被认可为替代方案。
– 管理与安全:强烈建议治疗后进行确认检测;遵循抗菌素管理原则;根除不会增加食管腺癌的风险,且微生物组的短暂紊乱通常在6-12个月内恢复。
– 计划实施:尽可能将幽门螺杆菌筛查整合到现有的预防健康计划中;组织质量保证、社区参与和随访系统。
关键信息点:
– 在高危环境中向幽门螺杆菌阳性的成人提供检测和治疗;客观确认根除(13C-UBT或HPSA)。
– 在大环内酯类耐药率较高的环境中,首选BQT;在适当情况下使用PCAB-阿莫西林双联疗法。
– 未经敏感性指导,不得重复使用克拉霉素或左氧氟沙星进行补救治疗。
更新的建议和关键变化(与2020年台北声明和其他先前指导相比)
主要更新及其驱动因素:
– 对人群筛查计划的更强操作支持。原因:两项大型实际/社区试验(JAMA 2024;Nat Med 2024)提供了筛查和治疗可减少胃癌发病率的人群水平证据——尽管效应大小有限且受依从性和试验设计的影响。
– 治疗方案层次更新:在大环内酯类耐药常见的地区,BQT仍然是首选的经验选择;最近的随机对照试验和荟萃分析显示,PCAB基双/三联方案(如伏诺拉生-阿莫西林)具有高根除率和良好的耐受性(Gut 2024-2025;Gastroenterology 2022)。
– 强调确认检测:强烈建议常规在治疗后(4-6周后使用UBT或HPSA)进行治愈测试,以确认根除并限制不必要的再治疗。
– 家庭为基础的方法:更明确地推荐和支持高流行率社区的家庭/户内筛查/根除,以减少再感染。
– 安全性考虑:系统评估长期微生物组和耐药组影响,并确认根除不会在人群水平上增加食管腺癌的风险。
总结表(简洁版):
– 筛查对象:居住在或来自高发病率地区的成年人,以及其他高危亚组(强烈推荐)。
– 首选筛查检测:13C-UBT或单克隆粪便抗原(强烈推荐)。
– 血清学检测:在低流行率地区,如果经过当地验证并由阳性结果进行确认检测,则可接受(有条件推荐)。
– 经验一线治疗:在克拉霉素耐药率中等至高的地区首选BQT;PCAB基方案为替代方案(强烈推荐)。
– 确认根除:在高危患者中强制执行,一般强烈推荐(强烈推荐)。
– 内镜检查:适用于有警报症状或额外高危标记的感染者;仅对高级别癌前病变或胃癌病史者进行监测(强烈推荐)。
分主题建议
(每个项目注明证据水平和推荐强度,如共识所述)
1) 根除的因果关系和效果
– 声明:幽门螺杆菌是胃腺癌的主要原因(高证据;强烈推荐)。
– 根除可降低胃癌风险(高证据;强烈推荐)。多项荟萃分析和大型队列研究显示相对风险降低;也有证据表明对死亡率有益。
2) 谁应优先筛查
– 主要目标:高胃癌发病率地区的成年居民和来自这些地区的移民(高证据;强烈推荐)。
– 理由:负担地理集中;成本效益模型支持针对高风险人群。
– 实践建议:绘制当地胃癌发病率地图,识别高流行率亚人群(如某些种族群体、土著社区),并试点组织化计划,包括邀请、检测、治疗和随访路径。
3) 最佳年龄和时机
– 声明:最佳年龄不确定,但越早越好;早期根除(在癌前病变之前)收益最大(中等证据;有条件推荐)。
– 实践说明:建模和可行性论证支持在高风险地区筛查年龄通常建议在30多岁中期至40多岁中期之间;与其他筛查(如45岁时的结直肠FIT)结合可能是务实的选择。
4) 筛查检测和诊断
– 首选检测:13C-UBT和单克隆HPSA(高证据;强烈推荐)。
– 血清学检测:在低流行率地区,如果检测方法经过当地验证,则可接受;阳性血清学检测必须在治疗前通过非血清学检测确认(中等证据;有条件推荐)。
– 检测时机:避免在PPIs/PCABs期间或之后立即检测(停用PPIs/PCABs 2周,抗生素/铋剂4周后再检测),以避免假阴性。
5) 治疗策略
– 经验治疗:如果在当地有效,则允许(中等证据;强烈推荐)。
– 一线治疗:在克拉霉素耐药率较高的地区,首选铋剂四联疗法(BQT:PPI/PCAB + 铋剂 + 四环素 + 甲硝唑);根据当地数据推荐10-14天疗程。PCAB-阿莫西林双联疗法(如伏诺拉生-阿莫西林)是一种有效的替代方案,得到RCT的支持(中等至高证据;强烈推荐)。
– 青霉素过敏:首选BQT;不包含阿莫西林的PCAB方案也是可接受的(中等证据;强烈推荐)。
– 补救/难治性治疗:未经敏感性确认,不得重复使用克拉霉素或左氧氟沙星;根据当地耐药性或AST选择补救方案(有条件推荐)。
6) 抗菌素管理
– 核心原则:幽门螺杆菌根除是感染性疾病的治疗,必须遵循管理原则(中等证据;强烈推荐)。
– 实践措施:选择受常见耐药性影响最小的方案,如有可用的敏感性指导治疗(分子或培养),确认治愈,监测当地根除结果和耐药趋势,并优先支持依从性。
7) 确认检测和内镜检查
– 确认根除:建议在完成治疗后4-6周通过13C-UBT或HPSA进行(中等证据;强烈推荐)。
– 上消化道内镜检查:建议对有警报症状、胃癌家族史、异常血清胃蛋白酶原或其他高危特征的感染者进行(中等证据;强烈推荐)。
– 监测:建议对有高级别癌前病变(OLGA/OLGIM III-IV,开放型萎缩)或胃癌病史的患者进行监测,即使成功根除后也是如此(中等证据;强烈推荐)。
8) 风险和长期安全性
– 反流性食管炎和食管腺癌:根除不会增加长期食管腺癌的风险(中等证据;强烈推荐)。
– 微生物组:根除会导致短暂的粪便微生物组紊乱,通常在6-12个月内恢复;临床意义尚不清楚(中等证据;有条件推荐)。
– 抗菌素耐药性:个体耐药性的增加通常是短暂的,会回到基线水平,但需要仔细监测和管理人群和环境影响(低至中等证据;有条件推荐)。
9) 家庭和社区方法
– 家庭为基础的筛查和治疗可能减少家庭内的传播,并提高高流行率社区的根除成功率(中等证据;有条件推荐)。
– 计划示例:台湾马祖计划、其他土著社区倡议和家庭指数方法展示了可行性和影响。
专家评论和见解
共识小组观点(意译):
– “幽门螺杆菌根除现在已被验证为许多环境中胃癌的一级预防工具。”(核心观点)
– 专家强调,受益程度因基线风险、依从性和时机而异;在优先考虑高发病率地区并实现高参与度和经验证的根除的情况下,人群受益最大。
– 委员会讨论了普遍筛查与目标筛查;一致支持优先考虑高风险地区和群体,同时建议在其他地方进行试点计划和本地评估。
– 争议仍然存在:开始筛查的最佳年龄;广泛根除与抗菌素管理之间的平衡;长期微生物组和人群耐药后果;以及如何最好地将幽门螺杆菌计划与现有癌症筛查服务相结合。
专家的关键实践信息:
– 将筛查和治疗作为有组织的计划实施,并设置质量指标:邀请/注册率、测试接受率、治疗完成率、治愈测试率和本地根除成功率。
– 使用本地耐药监测来指导经验选择;如有耐药性测试,使用分子AST定制治疗。
– 确保强有力的患者教育和依从性支持;考虑固定剂量或简化方案以提高完成率。
实践意义:将共识转化为实践
卫生系统层面的考虑:
– 将幽门螺杆菌筛查整合到现有的预防服务中(例如,在可行的情况下将粪便抗原采样与结直肠FIT结合),以节省成本并利用已建立的邀请基础设施(JAMA实际试验和台湾国家平台提供的证据和示例)。
– 试点实施:从高发病率地理区域或高风险亚人群开始,展示可行性,调整转诊路径并在本地优化成本效益。
临床实践工作流程(建议):
1. 确定筛查候选人(来自高发病率地区或其他高风险标准的成人)。
2. 提供非侵入性检测——首选13C-UBT或单克隆粪便抗原。
3. 如果阳性,咨询益处/风险并提供根除治疗,选择由当地耐药性指导的首选方案。
4. 治疗后,至少在治疗完成后4-6周(停用PPIs/PCABs后)进行治愈测试(13C-UBT或HPSA)。
5. 如持续感染,根据可用的敏感性测试选择补救方案;不要经验性地重复使用大环内酯类/氟喹诺酮类。
6. 对于有警报症状、异常胃蛋白酶原或家族史的患者,转介内镜检查和风险分层(OLGA/OLGIM)。
患者案例(示例):
约翰,一名48岁的韩裔美国人,没有警报症状,但有胃癌家族史(父亲62岁时确诊),前来初级保健。鉴于他的背景,他接受了幽门螺杆菌检测;13C-UBT呈阳性。经过咨询,他接受了14天的BQT(当地克拉霉素耐药率>15%)。他完成了治疗,仅有轻微恶心。治疗后6周,13C-UBT呈阴性——治疗成功得到记录。鉴于他的家族史,安排了上消化道内镜检查和基线胃映射,以便根据OLGA/OLGIM结果进行风险分层和监测计划。
未来研究优先领域(共识排名)
指南列出了九个优先研究领域。其中关键的包括:
– 确定筛查的最佳年龄,以最大化终生收益和成本效益。
– 定义有癌前病变患者的监测间隔和策略(OLGA/OLGIM分层)。
– 关于人群水平根除的长期微生物组、代谢和免疫后果的研究。
– 开发和临床测试幽门螺杆菌疫苗(预防性和治疗性)和非抗生素疗法(脲酶抑制剂、抗黏附剂)。
– 大规模多国实施研究,评估人群结果、耐药生态学和大规模抗生素使用的环境影响。
保持不变的内容——持久的原则
– 幽门螺杆菌仍然是1类致癌物,是胃癌预防的行动目标。
– 在内镜检查能力存在且疾病负担非常高的地区,将根除与内镜筛查结合仍然是合理的策略。
– 确认治愈仍然是良好临床实践的基石,以验证根除并限制不必要的再治疗。
最后的思考:平衡利益、危害和可行性
2025年《台北全球共识II》将领域从概念上的认可推进到实际、基于证据的实施建议。该指南强调,根除可以降低胃癌风险并预防消化性溃疡病,但在人群水平上的效果取决于计划设计:谁被邀请,使用哪种测试,选择哪种方案,以及是否有确认检测和监测基础设施。抗菌素管理和持续监测耐药性是必不可少的,同样重要的是投资研究——特别是疫苗开发和非抗生素疗法——这将减少对全身抗生素的依赖。
对于临床医生和公共卫生领导者来说,信息是明确的:在胃癌风险升高的环境中,有质量保证、社区参与和管理保障的组织化幽门螺杆菌筛查和治疗计划现在得到了更强的证据和实用建议的支持。