亮点
– 新辅助铂类化疗加 PD-1/PD-L1 阻断在 29 例可切除的 SMARCA4 改变的 NSCLC 中产生了 51.7% 的病理完全缓解 (pCR) 率;受益主要集中在鳞状组织学(pCR 83.3% 对腺癌 28.6%,p=0.045)。
– SMARCA4 改变的肺腺癌表现出不同的免疫表型;免疫荒漠型病例的生存明显差于免疫富集型病例。
– 在晚期疾病中,SMARCA4 突变使肿瘤突变负荷 (TMB) 增加,但总体中位总生存期 (OS) 更短;与 SMARCA4(通常还有 KRAS)共存的 STK11 和/或 KEAP1 突变在接受化免联合治疗后的无进展生存期 (PFS) 和总生存期 (OS) 显著缩短。
背景
SMARCA4 编码 BRG1,即 SWI/SNF 染色质重塑复合物的催化亚基。SMARCA4 功能丧失改变发生在一部分非小细胞肺癌 (NSCLC) 中,并与侵袭性生物学、吸烟相关性和不良预后有关。免疫检查点阻断联合化疗在可切除和晚期 NSCLC 中普遍改善了预后,但尚不清楚 SMARCA4 改变的肿瘤是否获得同样的益处,或者预后是否因组织学和共突变背景而异。
研究设计和方法
本文综合了两项最近的回顾性分析,探讨了 SMARCA4 改变与新辅助和晚期疾病免疫化疗预后的关系。
研究 1 (Peng 等, J Thorac Oncol, 2025): 单中心(广东省人民医院)回顾性系列研究,纳入 29 例携带 SMARCA4 改变的可切除 NSCLC 患者,接受新辅助免疫化疗。临床特征与下一代测序 (NGS) 相关。作者还通过 SMARCA4 状态(全外显子组测序)分析了癌症基因组图谱 (TCGA) 肺腺癌队列,并使用 BostonGene 分子功能肖像分类改变队列中的肿瘤免疫微环境。
研究 2 (Dong 等, Transl Lung Cancer Res, 2025): 基于 cBioPortal 的分析,涉及 2,098 例 IIIB-IV 期 NSCLC 病例(排除经典驱动突变 EGFR、ALK、ROS1、RET),探讨 SMARCA4 突变的患病率及其对化免联合治疗预后的影响,特别是 STK11/KEAP1 共突变对预后的影响。通过多变量模型评估 TMB、PD-L1 表达、一线治疗无进展生存期 (mPFS1) 和总生存期 (mOS) 的关联。
两项研究的关键终点包括客观缓解率 (ORR)、新辅助病例的病理完全缓解 (pCR)、无事件生存期 (EFS) 或无进展生存期 (PFS) 以及总生存期 (OS)。通过免疫分类(免疫荒漠型 vs 免疫富集型)和通路分析探索生物学相关性。
关键发现
新辅助系列研究 (Peng 等)
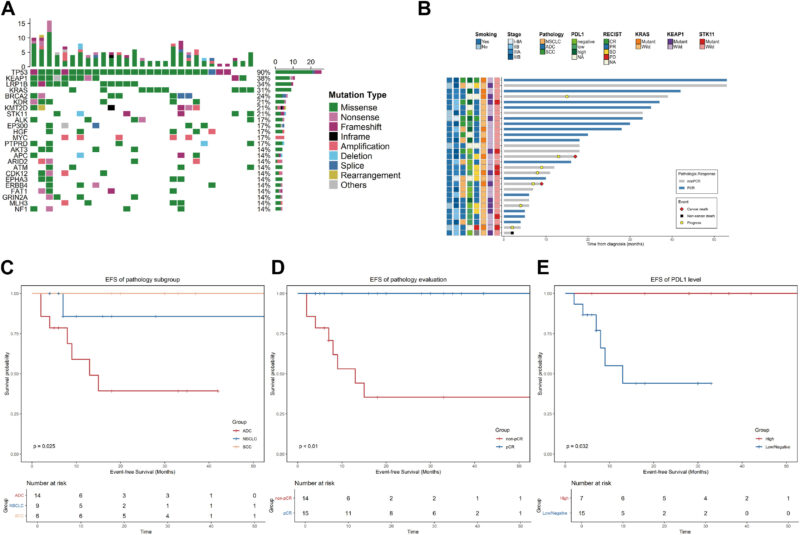
在 29 例接受新辅助免疫化疗的 SMARCA4 改变的可切除 NSCLC 患者中,总客观缓解率为 70.4%,pCR 率为 51.7%。重要亚组发现包括:
- 组织学很重要:pCR 因病理类型而异——鳞状细胞癌 (SCC) 的 pCR 率为 83.3%,而腺癌为 28.6%(p = 0.045)。
- 复发和生存:中位随访 17 个月后,7 名患者复发;报告 1 例非癌症死亡。在腺癌亚组中,有早期进展的信号(42.8%),中位 EFS 约为 13 个月,尽管一些腺癌患者实现了持久的疾病控制。
- 共突变风险:伴有 KRAS 和 KEAP1/STK11 共突变的患者在该队列中均复发,表明这是一种特别高风险的表型。
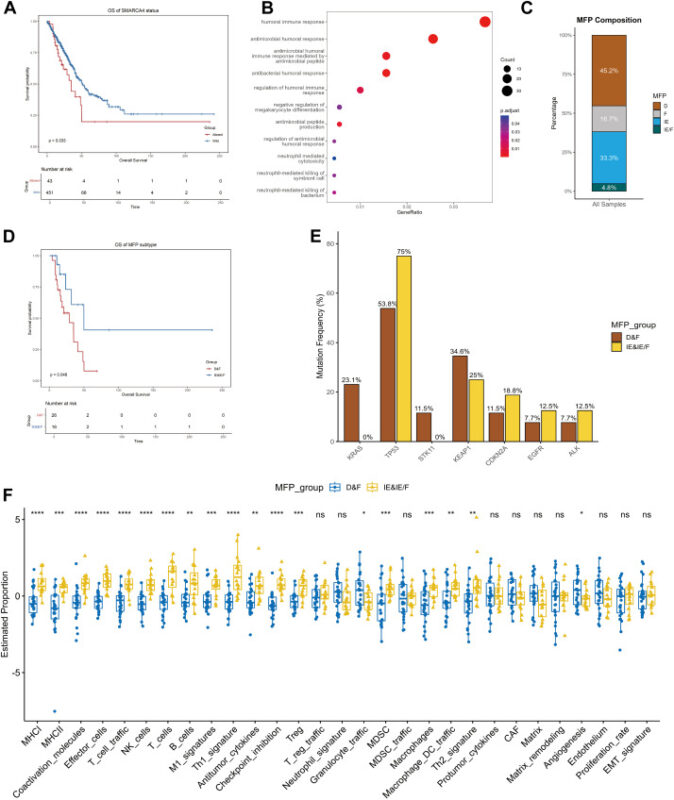
TCGA LUAD 分析反映了临床观察结果:SMARCA4 改变的腺癌生存更差(中位 34.8 个月 vs 50.9 个月,p = 0.033),并且转录特征与先天免疫下调和 mTOR 及 MYC 信号通路富集一致。
免疫微环境分类(BostonGene)揭示了 SMARCA4 改变的肿瘤内的异质性:存在免疫荒漠型和免疫富集型亚型。缺乏免疫细胞浸润的患者的 OS 显著短于免疫富集型病例(28.8 个月 vs 49.9 个月,p = 0.043)。
晚期疾病 cBioPortal 分析 (Dong 等)
在 2,098 例晚期 NSCLC 病例中,162 例 (7.7%) 携带 SMARCA4 突变。关键观察结果包括:
- 临床表型:SMARCA4 突变患者更常见的是年龄较大、当前或既往吸烟者,并且更可能有肾上腺转移。
- 基因组特征和预后:SMARCA4 突变肿瘤的 TMB 较高 (P<0.001),但中位 OS 较短 (10.6 个月 vs 17.5 个月,P<0.001)。SMARCA4 I 类改变的 mOS 和 mPFS 较短,而 II 类改变则较短。
- 添加免疫疗法的影响:在 SMARCA4 突变患者中,一线化免联合治疗相比单独化疗延长了中位 PFS1(5.6 个月 vs 3.9 个月,P=0.01),但在队列水平上未改善 mOS(10.8 个月 vs 9.5 个月,P=0.91)。
- 获益预测因子:PD-L1 阳性在化免联合治疗组中预测更长的 mPFS1(8.3 个月 vs 5.1 个月,P=0.02)和 mOS(18.9 个月 vs 9.3 个月,P=0.03);TMB 在此亚组中未分层获益。
- STK11/KEAP1 共突变:SMARCA4 与 STK11 和/或 KEAP1 共突变的存在与 TMB 或 PD-L1 无关,但显著降低了化免联合治疗的获益——mPFS1 为 4.5 个月 vs 13.3 个月 (P<0.001),mOS 为 8.7 个月 vs 20.1 个月 (P=0.005)。在 SMARCA4 突变人群中,没有 STK11/KEAP1 共突变的患者从免疫疗法中获得了显著的 mPFS1 获益;当存在 STK11/KEAP1 共突变时,这种获益减弱或消失。
解释和机制考虑
总体而言,这些分析表明,SMARCA4 改变的 NSCLC 不是一个单一的临床实体,而是由组织学和共突变背景定义的谱系。几个机制和转化要点值得注意:
- SMARCA4 缺失可能会增加基因组不稳定性并提高 TMB——这可能有利于免疫原性——但在某些亚群中,共突变会主动塑造免疫微环境,从而覆盖这一效应。
- 先前的研究表明,STK11 (LKB1) 丢失与免疫冷微环境、受损的 STING 信号传导和减少的 T 细胞浸润有关;KEAP1 失活激活 NRF2 和代谢程序,可以进一步削弱免疫监视。与 SMARCA4 共存的这些病变可能建立一个对免疫检查点阻断反应不佳的免疫荒漠表型。
- 新辅助设置中的组织学依赖性反应(鳞状细胞癌中的强 pCR)可能反映了鳞状细胞癌和腺癌之间基线免疫原性、肿瘤间质背景或共突变模式的差异,而不是 SMARCA4 丢失本身的直接影响。
- 在 SMARCA4 改变的腺癌中识别出的 mTOR 和 MYC 通路富集表明,可以探索与免疫疗法联合使用的替代治疗脆弱性以克服耐药性。
专家评论和局限性
这些回顾性的假设生成数据集提供了重要的临床信号,但也有一些限制,需要谨慎应用于实践:
- 样本量和选择偏差:新辅助系列仅包括来自单中心的 29 名患者;手术和机构实践的选择可能影响预后。
- 回顾性设计:两项研究均为回顾性和观察性研究;指示性混杂和不完整的临床注释(例如,既往治疗、合并症、PD-L1 测定一致性)可能影响治疗效果估计。
- 测试和突变分类的异质性:SMARCA4 改变包括截断、错义和结构事件;并非所有改变都会产生同等的功能丧失。研究部分解决了这一点(I 类 vs II 类),但仍需要更标准的功能注释。
- 生物标志物相互作用:PD-L1 和 TMB 的信息不一;不一致或不完整的 PD-L1 数据限制了其在 SMARCA4 突变疾病中预测作用的确切结论。
- 机制推断:转录组学和通路富集发现是关联性的;需要基于组织的前瞻性研究,结合单细胞和空间分析来确认免疫排斥机制。
然而,STK11/KEAP1 共突变确定了一组在化免联合治疗中预后较差的亚群,这一可重复的信号与先前文献一致,这些文献将这些改变(尤其是在 KRAS 突变肿瘤中)与免疫抵抗联系起来。这些数据支持在选择治疗前使用全面的 NGS 面板检测 SMARCA4、KRAS、STK11 和 KEAP1 突变。
临床意义和建议
对于临床医生和多学科胸部团队,最可行的要点是:
- 在可切除和晚期 NSCLC 中进行全面基因组谱型(NGS),以检测 SMARCA4 和共存突变(KRAS、STK11、KEAP1),指导预后和免疫疗法的可能响应性。
- 新辅助免疫化疗在 SMARCA4 改变的鳞状 NSCLC 中高度活跃,可产生高 pCR 率;在等待前瞻性验证的情况下,携带 SMARCA4 丢失的候选鳞状细胞癌患者可能特别受益于这一策略。
- 在非鳞状 SMARCA4 改变的 NSCLC 中,评估共突变背景:KRAS 与 STK11/KEAP1 共突变标记了一个高风险、免疫冷的亚组,标准化免联合治疗往往收益有限——这些患者应优先参加测试新型组合(例如,调节肿瘤微环境的药物、靶向代谢方法或针对 mTOR/MYC 信号通路的组合)的临床试验。
- 如有条件,考虑额外的免疫谱型(PD-L1、转录组免疫特征、空间免疫表型)以细化对免疫疗法获益的预测。
下一步研究
需要前瞻性试验根据 SMARCA4 状态和共突变模式进行分层,以验证这些观察结果。优先问题包括:
- 能否通过合理的组合(STING 激动剂、表观遗传修饰剂、代谢途径抑制剂或 NRF2/KEAP1 轴干预)重新敏感化 SMARCA4 突变的免疫冷肿瘤?
- 不同 SMARCA4 改变类别在辅助/新辅助治疗中的获益是否存在差异,能否指导治疗强度?
- 哪些具体的转录组或空间生物标志物最能捕捉免疫排斥并预测 SMARCA4 改变的 NSCLC 中的耐药性?
结论
SMARCA4 改变的 NSCLC 在临床和生物学上具有异质性。目前的回顾性证据表明,鳞状 SMARCA4 改变的肿瘤对新辅助免疫化疗非常敏感,而非鳞状肿瘤(尤其是那些携带 KRAS 加 STK11 和/或 KEAP1 共突变的肿瘤)构成一个免疫冷、高风险亚组,从标准化免联合治疗中获益有限。这些发现支持常规进行全面基因组谱型以指导治疗决策,并优先进行前瞻性试验,测试定制的组合策略以克服这一具有挑战性的分子亚群的免疫抵抗。
资助和 clinicaltrials.gov
资助和试验注册:各研究的资助和临床试验标识符已在原始论文中报告(Peng 等, J Thorac Oncol 2025; Dong 等, Transl Lung Cancer Res 2025)。读者应查阅这些报告以获取详细的致谢和试验信息。本文综合中未作额外的资助声明。
参考文献
1. Peng LS, Cui Q, Zhang C, et al. Neoadjuvant Immunochemotherapy in Resectable NSCLC With SMARCA4 Alterations. J Thorac Oncol. 2025 Oct 27. doi:10.1016/j.jtho.2025.10.013 IF: 20.8 Q1 . PMID: 41161592 IF: 20.8 Q1 .
2. Dong Z, Zuo R, Guo Y, et al. STK11/KEAP1 co-mutations in SMARCA4-mutant advanced non-small cell lung cancer: genetic characteristics and impact on immunotherapy efficacy. Transl Lung Cancer Res. 2025 Aug 31;14(8):3024-3041. doi:10.21037/tlcr-2025-305 IF: 3.5 Q1 . PMID: 40948837 IF: 3.5 Q1 ; PMCID: PMC12432681 IF: 3.5 Q1 .
3. The Cancer Genome Atlas Research Network. Comprehensive molecular profiling of lung adenocarcinoma. (TCGA LUAD) — see original TCGA publications for datasets used in secondary analyses.
注意:本文综合并解释了已发表的发现。临床医生应查阅原始论文以获取完整的方法学细节和机构治疗方案。