引言
感音神经性听力损失(SNHL)影响全球超过 15 亿人,是导致残疾的主要原因之一。其多因素病因包括基因突变、环境伤害(如噪音暴露)、耳毒性药物、衰老和病毒感染。越来越多的证据表明,NOD 样受体含吡啶结构域 3(NLRP3)炎症小体是许多 SNHL 形式中炎症诱导耳蜗损伤的关键驱动因素。这种先天免疫复合物的异常激活触发了促炎细胞因子释放和焦亡细胞死亡的级联反应,导致进行性和往往不可逆的听觉功能障碍。本文综述了 NLRP3 炎症小体在不同听力损失病因中的机制作用,并强调了针对这一通路的新兴治疗候选药物及其转化潜力。
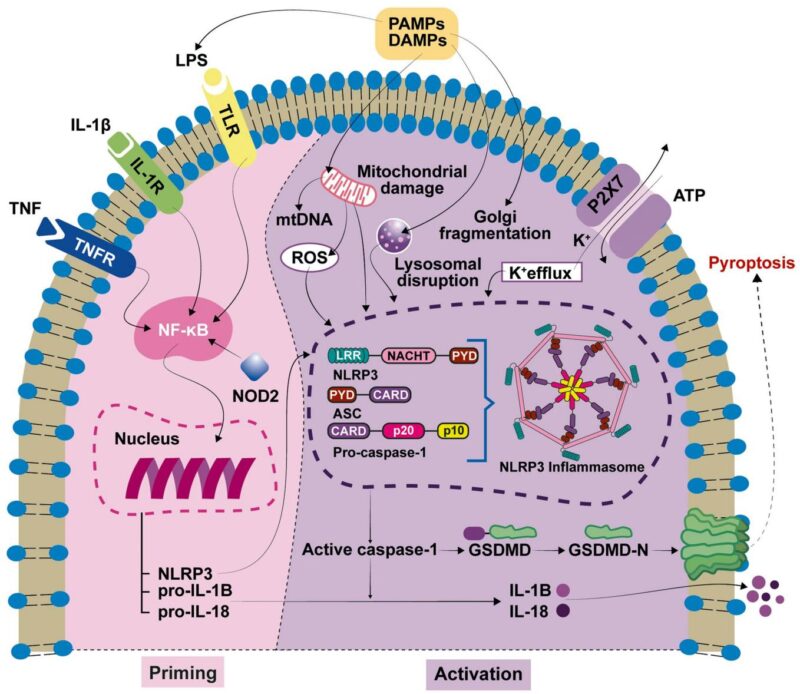
NLRP3 炎症小体生物学及其在耳蜗中的激活
NLRP3 炎症小体是一种胞质多蛋白复合物,由 NLRP3 感应蛋白、接头蛋白 ASC 和前半胱天冬酶-1 组成,作为病原体和无菌危险信号的胞内哨兵。激活过程涉及两个步骤:首先是启动信号,通常由模式识别受体(如 TLRs)识别病原体或损伤相关分子模式(PAMPs 和 DAMPs),诱导炎症小体成分和促炎细胞因子前体 IL-1β 和 IL-18 的转录上调;其次是激活步骤,由离子流、活性氧和线粒体损伤等多种刺激触发 NLRP3 寡聚化、ASC 招募、半胱天冬酶-1 激活以及前体 IL-1β/IL-18 裂解为生物活性细胞因子。半胱天冬酶-1 还裂解气孔素 D(GSDMD),其 N 端片段在细胞膜上形成孔道,导致焦亡细胞死亡和细胞因子释放。
在耳蜗中,NLRP3 炎症小体成分主要表达在常驻巨噬细胞、血管纹边缘细胞、支持细胞和螺旋神经节神经元中,使这一先天免疫平台成为耳蜗稳态和炎症病理的核心。NLRP3 激活诱导 IL-1β 和 IL-18 分泌,传播炎症并可能破坏对毛细胞和神经元功能至关重要的精细耳蜗微环境。
NLRP3 炎症小体在听力损失病因中的作用
遗传性听力损失和自身炎症综合征
NLRP3 基因突变可导致冷吡啉相关周期性综合征(CAPS),包括家族性寒冷自身炎症综合征(FCAS)、穆克-韦尔斯综合征(MWS)和慢性婴儿神经皮肤关节综合征(CINCA),这些综合征常伴有感音神经性听力损失。功能增益突变导致过度产生 IL-1β、系统性炎症和耳蜗自身炎症。CAPS 的患病率较低,但由于诊断延迟而可能被低估。基因分析,包括靶向和全外显子组测序,显示某些 NLRP3 变异主要表现为听力损失而无明显全身症状(归类为 DFNA34),突显了炎症听力表型的谱系。
表达患者来源 NLRP3 突变的动物模型验证了炎症小体激活在耳蜗炎症和听力缺陷中的致病作用,尽管严重的全身效应限制了一些模型的早期听觉表型分析。条件性小鼠模型通过靶向耳蜗表达突变 NLRP3 展现了与炎症和耳蜗结构破坏相关的严重听力损失,重现了人类疾病的特征。
获得性和环境性听力损失
实验研究表明,NLRP3 炎症小体激活与噪声引起的听力损失(NIHL)、年龄相关性听力损失(ARHL)和耳毒性药物引起的听觉损伤有关。噪声暴露诱导耳蜗释放 DAMPs,触发炎症小体组装和升高的 IL-1β/IL-18,药理学抑制可在临床前模型中提供保护。ARHL 与升高的耳蜗炎症小体激活相关,提示慢性低度炎症有助于与年龄相关的听觉衰退。
顺铂和氨基糖苷类抗生素通过 NLRP3 依赖性激活诱导耳毒性,促进耳蜗毛细胞和边缘细胞的焦亡。值得注意的是,如奥利多宁和 MCC950 等药物通过阻断炎症小体组装和下游信号传导缓解耳毒性损伤。病毒性感染(如巨细胞病毒)也可通过炎症小体介导的耳蜗神经元死亡,导致先天性 SNHL。
其他内耳病变
新兴数据表明,NLRP3 炎症小体激活与美尼尔病和前庭神经鞘瘤相关的听力损失有关,突显了其在影响听觉功能的内耳炎症过程中更广泛的作用。
针对 NLRP3 炎症小体的听力损失治疗
目前 FDA 批准的 CAPS 治疗药物包括 IL-1 通路阻断剂,如阿那白滞素(IL-1R 拮抗剂)和卡纳单抗(抗 IL-1β 单克隆抗体),这些药物可以在早期使用时稳定或改善听力结果。利洛那西普和实验性单克隆抗体如吉沃珠单抗正在临床评估中。
直接 NLRP3 抑制剂,包括 MCC950 和达潘司特利(OLT1177)的临床前和早期临床进展,为更广泛的 SNHL 治疗提供了有希望的途径,不仅限于 CAPS。天然化合物如白藜芦醇醇和奥利多宁通过抑制炎症小体激活和焦亡,在 ARHL、NIHL 和药物引起的耳毒性模型中表现出免疫调节和耳保护作用。
药物再利用努力的一个例子是反苯环丙胺对炎症小体信号传导的抑制作用,扩大了潜在的治疗选择。对于对药物治疗无反应的晚期病例,人工耳蜗植入仍然是一个重要干预措施。
结论与未来方向
NLRP3 炎症小体通过调节耳蜗炎症和细胞死亡通路,成为多种起源的 SNHL 的中心致病介质。遗传和实验数据汇聚支持其作为预防或阻止进行性听力损失的治疗靶点。目前正在临床开发中的新型选择性 NLRP3 抑制剂预示着一类新的靶向治疗药物,有望改变管理方式。未来的研究重点包括在人体临床试验中验证这些药物、识别可靠的早期检测生物标志物,以及探索整合抗炎、抗氧化和再生疗法的组合策略,以优化听力保护。
分子成像和动物模型的进展将加速机制洞察,促进炎症小体靶向治疗向临床实践的转化,为数百万受致残性听力损失影响的人们带来希望。
参考文献
Murillo-Cuesta S, Seoane E, Cervantes B, Zubeldia JM, Varela-Nieto I. NLRP3 inflammasome and hearing loss: from mechanisms to therapies. J Neuroinflammation. 2025 Oct 4;22(1):225. doi: 10.1186/s12974-025-03561-w . PMID: 41046290 ; PMCID: PMC12497346 .



