亮点
- 鉴定出胚系和体细胞L858R EGFR变异是导致综合征性广泛性黑棘皮病(AN)和肺部病变的原因。
- 临床特征包括早期出现的皱褶部位皮肤增厚、口周色素沉着、羊毛状头发和掌跖角化症。
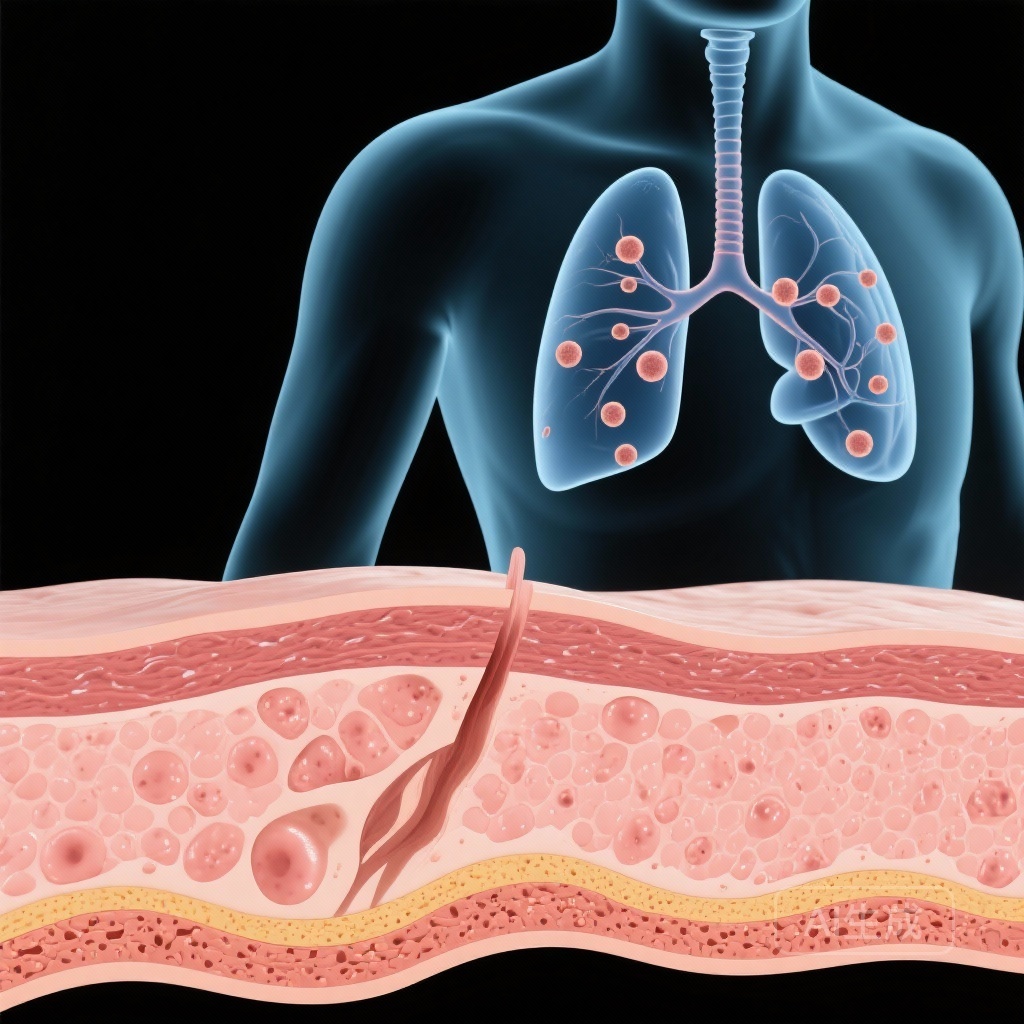
- 在受影响个体中检测到肺结节,这些结节可能是肺腺癌的前驱病变。
- 全身使用EGFR酪氨酸激酶抑制剂(TKIs)治疗后,皮肤和肺部症状几乎完全缓解。
背景
黑棘皮病(AN)是一种常见的皮肤病标志,通常与胰岛素抵抗、肥胖和内分泌紊乱有关。然而,当AN在生命早期出现、广泛分布或在没有高血糖的情况下发生时,可能提示潜在的遗传综合征或内部恶性肿瘤。虽然表皮生长因子受体(EGFR)的功能获得性变异是已知的非小细胞肺癌(NSCLC)驱动因素,但其在引起系统性综合征性皮肤病中的作用直到最近才得到明确定义。
EGFR通路对角质形成细胞的增殖和分化至关重要。通过体细胞突变过度激活这一通路是致癌的标志,但新生胚系突变——特别是第21外显子的L858R替代——提出了独特的临床挑战。本研究调查了严重早发性综合征性AN的遗传基础,并探讨了使用EGFR抑制剂进行病理导向治疗的治疗潜力。
研究设计
这项病例系列研究涉及三名具有不同临床表现的严重皮肤增厚和色素沉着的参与者。两名个体表现为正常血糖水平和早期出现的口周色素沉着,随后发展为广泛的皱褶部位皮肤增厚。第三名个体最初被诊断为广泛的表皮痣。参与者的年龄范围为8至18岁。
研究团队采用多学科方法来表征该疾病:
-
基因分析:
对血液和皮肤样本进行了全外显子组测序(WES),以识别致病变异。
-
分子验证:
在受影响的皮肤组织和培养的角质形成细胞中进行了研究,评估EGFR通路的激活情况,特别是下游信号分子如MAPK的激活。
-
临床评估:
参与者接受了全面的肺功能测试和高分辨率肺成像(CT扫描),以筛查系统性受累情况。
-
治疗干预:
研究监测了这些患者接受全身EGFR抑制剂治疗的临床反应,评估皮肤质地和肺结节负担的变化。
主要发现
基因组和分子驱动因素
所有三名参与者均携带EGFR L858R变异。在两名有广泛皮肤受累的病例中,变异为新生胚系变异,而局部表皮痣表现的个体则表现出体细胞嵌合变异。对病变皮肤和培养的角质形成细胞的分析证实EGFR通路活性显著增加。体外药理抑制成功地抑制了这种过度激活,为全身治疗提供了依据。
表型表现
胚系病例的临床表现非常一致。主要特征包括:
- 广泛的获得性角化病,在皱褶部位(腋窝、颈部、腹股沟)显著加重。
- 羊毛状头发质地和掌跖角化症。
- 早期出现的口周色素沉着。
关键在于,研究发现了显著的肺部受累。肺成像显示参与者存在多个肺结节。鉴于L858R变异是已知的肺腺癌驱动因素,这些结节被认为是前驱病变,使这些年轻患者面临极高的终身肺部恶性肿瘤风险。
EGFR抑制的治疗效果
从分子发现到临床应用的转变带来了显著的结果。接受全身EGFR抑制剂治疗(如厄洛替尼或吉非替尼)的患者皮肤疾病显著消退。更重要的是,随访成像显示肺结节数量和大小的减少或消失。这表明TKIs可以作为这一患者群体的治疗和预防措施。
专家评论
这项研究重新定义了我们对EGFR信号传导与皮肤生理关系的理解。在临床医学的背景下,“EGFR-AN综合征”的识别为儿科皮肤科医生和肿瘤科医生提供了一个重要的诊断框架。当临床医生遇到血糖代谢正常的广泛性AN患者时,应考虑进行EGFR变异的基因筛查。
L858R变异与观察到的表型之间的机制联系是生物学上合理的。EGFR信号传导促进棘层的扩张并抑制终末分化,导致皮肤的过度角化和棘皮病特征。在肺部,同一突变促进肺泡上皮细胞的克隆扩增,导致结节形成。本研究中TKI治疗的成功突显了精准医疗的力量:通过靶向特定的分子驱动因素,临床医生可以治疗可见的皮肤疾病和不可见的、危及生命的肺部前驱病变。
结论
Jiang等人的研究表明,新生胚系L858R EGFR变异导致了一种多系统综合征,其特征为广泛性黑棘皮病和高肺部疾病风险。这一发现将严重AN的诊断范式从代谢焦点转向基因组焦点。早期识别至关重要,因为它允许启动EGFR靶向治疗,该治疗在逆转皮肤表现方面显示出显著效果,并可能防止肺结节进展为侵袭性腺癌。需要进一步的长期研究来确定TKI治疗的最佳持续时间和这些患者的长期预后。
参考文献
Jiang X, Jeng MY, Yang Z, et al. De Novo Germline L858R EGFR Variants and Generalized Acanthosis Nigricans. JAMA Dermatol. Published online January 14, 2026. doi:10.1001/jamadermatol.2025.5414