亮点
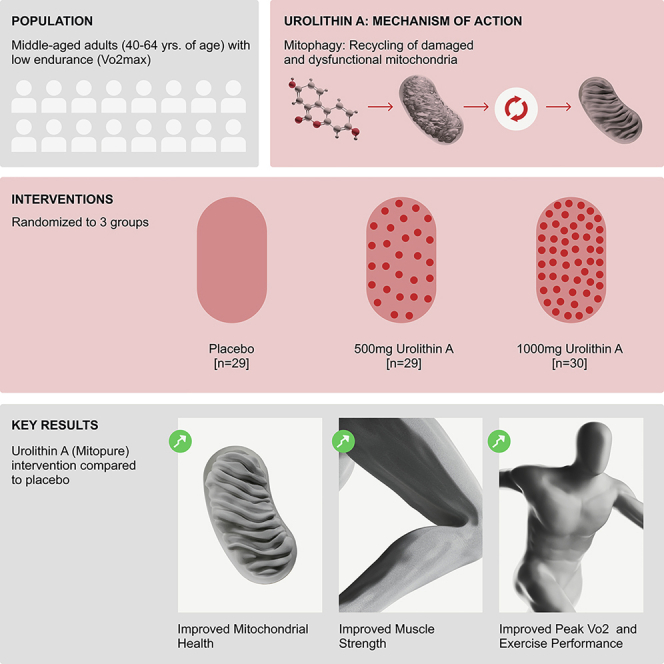
Urolithin A (UA; Mitopure) 口服给药 4 个月,对中年、超重、久坐不动的成年人是安全的,并且与以下方面相关:1) 下肢(腘绳肌)力量显著改善(500 mg 组 +12%,1,000 mg 组 +9.8% 对比安慰剂),2) 1,000 mg 剂量组有氧能力和步行距离的临床意义增加(最大摄氧量组内增加约 10%;6 分钟步行距离 +33.4 米),以及 3) 肌肉蛋白质组学和生化特征与 Parkin 介导的自噬激活和线粒体 OXPHOS 蛋白升高一致,同时系统性 CRP 和选择性炎症细胞因子减少。
研究背景和临床需求
随着年龄增长,肌肉质量和力量的下降(肌少症和动态障碍)是导致残疾和丧失独立性的主要驱动因素。恢复肌肉生物能量和细胞器质量控制——特别是线粒体自噬——的干预措施非常有吸引力,因为线粒体功能障碍会随着年龄增长而降低肌肉性能并引起全身炎症。Urolithin A 是一种由饮食中的鞣花单宁通过肠道微生物代谢产生的代谢物,在临床前研究中已被证明可以激活线粒体自噬、恢复线粒体功能并改善肌肉功能(Ryu 等,Nat Med 2016)。早期的人类研究报告称,在短期 UA 给药后,安全性良好且线粒体健康的分子特征有所改善(Andreux 等,Nat Metab 2019),并且在老年人中进行的随机试验报告称,长期补充后肌肉耐力有所改善(Liu 等,JAMA Netw Open 2022)。ATLAS 试验旨在评估两种 UA 剂量在 4 个月内对低基础有氧能力(VO2max < 35 mL/kg/min)的久坐不动、超重中年人的功能和分子效应。
研究设计
这是一项单中心、随机、双盲、安慰剂对照、平行组概念验证试验(NCT03464500)。88 名年龄在 40-64 岁之间、BMI 25-34.9 kg/m2、久坐不动且 VO2max 较低的参与者被随机分配至安慰剂组(n=29)、UA 500 mg/天组(n=29)或 UA 1,000 mg/天组(n=30),持续 120 天。主要终点是次极限递增骑行测试中的峰值功率输出(PPO)。次要和探索性终点包括等速下肢力量(Biodex 动态测量)、手握力、最大摄氧量(预测值)、6 分钟步行试验(6MWT)、疲劳时间、DXA 身体成分、血浆生物标志物(酰基肉碱、CRP、细胞因子)、肌肉转录组学和非靶向蛋白质组学,以及肌肉活检亚组的靶向 Western 印迹验证。分析报告了意向治疗(ITT)和符合方案人群;大多数终点是探索性的,试验作为概念验证设计。
关键发现
功能结果
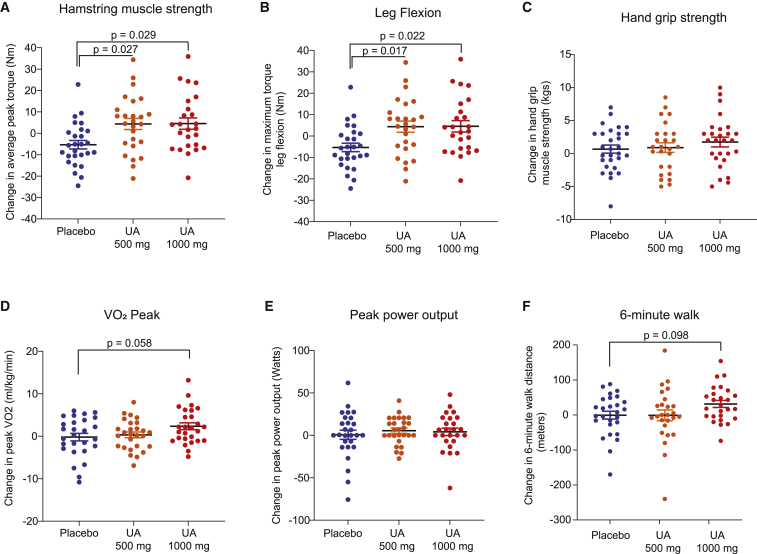
– 下肢力量:两种 UA 剂量均显示出相对于安慰剂的统计学显著改善。腘绳肌平均峰扭矩分别增加了约 12%(500 mg,p=0.027 对比安慰剂)和 9.8%(1,000 mg,p=0.029 对比安慰剂)。膝关节屈曲期间的最大扭矩在两种剂量下均提高了约 10.5-10.6%(p≤0.022)。相比之下,股四头肌指标呈有利趋势但未达到统计学显著性。手握力显示无显著趋势(1,000 mg 组提高 5.1%;p=0.08)。DXA 测定的瘦体重在 4 个月内未发生变化。
有氧耐力和身体表现
– 主要终点:PPO 显示出非显著增加(UA 组从基线增加约 4%),与安慰剂无差异。
– 最大摄氧量和预测最大摄氧量:1,000 mg UA 组在 2 个月和 4 个月时组内最大摄氧量显著增加(约 10% 的基线增加;p<0.01)。与安慰剂相比,组间差异接近但未达到传统显著性阈值(p≈0.058 对于最大摄氧量)。
– 6 分钟步行试验:1,000 mg UA 组步行距离平均增加了 33.4 米(组内 p=0.0008;与安慰剂相比 p≈0.098)。30 米的变化通常被认为是老年人的最小临床重要差异(Perera 等,J Am Geriatr Soc 2006)。
– 疲劳时间和骑行距离在 1,000 mg 组中有所改善(骑行距离 +15%,组内 p≈0.03)。
Urolithin A oral administration significantly improves leg muscle strength and impacts aerobic endurance in middle-aged adults
生物标志物和肌肉分子读数
– 血浆生物利用度:4 个月后,两种剂量的 UA 及其结合物(葡萄糖醛酸酯、硫酸盐)均可检测到,证实了依从性和系统暴露。
– 代谢组学:500 mg 组血浆酰基肉碱(尤其是中/长链种类)减少,表明线粒体脂肪酸氧化和代谢效率提高(Schooneman 等,Diabetes 2013)。1,000 mg 组在该时间点未表现出相同的酰基肉碱模式,提示可能的剂量或时间依赖性动力学。
– 炎症:高敏 CRP 随 UA 减少(1,000 mg 组统计显著),选择性促炎细胞因子(IFN-γ、IL-1β、TNF-α)集体呈现下降趋势,表明轻微的系统性抗炎作用。
– 肌肉转录组和蛋白质组:RNA-seq 显示 500 mg 组线粒体、核糖体和收缩纤维基因集富集(调整后 p<0.1)。非靶向蛋白质组学显示与 Parkin 介导的泛素-蛋白酶体系统(500 mg)和线粒体 TCA 循环、脂肪酸氧化和 OXPHOS 蛋白(1,000 mg)相关的通路上调。靶向 Western 印迹确认 500 mg 后磷化 Parkin (Ser65) 增加,1,000 mg 组复合物 I-III OXPHOS 蛋白呈剂量依赖性增加,支持线粒体自噬激活和线粒体蛋白丰度提高。观察到 mtDNA/nDNA 比率小幅增加。
安全性
UA 耐受性良好。各组不良事件大多轻微,部分与肌肉活检程序有关;总体 AE 计数在安慰剂和 UA 组之间相似。4 个月内未出现临床上有意义的生命体征、血液学、化学面板或尿液分析变化。未报告严重安全信号。
机制解释和生物学合理性
临床前数据显示,UA 通过 PINK1/Parkin 途径激活线粒体自噬,改善肌肉线粒体质量和功能(Ryu 等,Nat Med 2016)。ATLAS 蛋白质组学和 Western 印迹数据——UBE2N、磷化 Parkin 和 OXPHOS 蛋白增加——与线粒体自噬激活导致线粒体网络更新和氧化能力提高相符。观察到的酰基肉碱和 CRP 减少在生理上与线粒体脂肪酸处理改善和减少衰老炎症一致,这两者都可以有助于改善肌肉耐力和步行表现。
局限性和专家观点
这仍是一项单一中心的概念验证研究,具有探索性终点。预设的主要终点(PPO)未达到,且若干重要结果显示出组内而非组间显著性。样本量和单中心招募限制了普遍性。研究人群超重、久坐不动且女性占多数(约 2:1),可能不代表患有肌少症的虚弱老年人。一些分子信号在剂量和模态(转录组学 vs 蛋白质组学)之间有所不同,反映了时间依赖性和剂量依赖性药效动力学的复杂性。此外,试验由产品开发者资助;独立复制是可取的。尽管存在这些局限性,功能性改善(特别是 1,000 mg 组的腘绳肌力量和具有临床意义的 6MWT 增加)、系统性生物标志物变化和线粒体自噬激活的蛋白质组学证据提供了一个合理的、机制一致的信号,值得进一步验证试验。
临床意义和推荐下一步
对于临床医生而言,UA 尚未被批准用于治疗肌少症,但这些数据表明 UA 值得进一步研究作为营养或辅助策略,以保持或改善肌肉力量和耐力,特别是在运动受限或依从性较差的情况下。未来试验应充分设计、多中心、持续时间更长(≥6-12 个月),包括老年人和肌少症患者,预设在此研究中呈阳性的主要终点(如腘绳肌扭矩、6MWT 或最大摄氧量),检查剂量-反应和时间过程,并包括客观活动监测。机制亚研究应继续使用标准化活检时间来协调转录组学和蛋白质组学变化,并探索对临床结局(跌倒、行动障碍)和代谢终点(胰岛素敏感性)的影响。
结论
ATLAS 随机试验表明,4 个月的口服 Urolithin A 是安全的,生物利用度高,并且与下肢力量改善、有氧能力和步行能力改善信号(尤其是在 1,000 mg 剂量下)、炎症生物标志物减少以及与 Parkin 介导的线粒体自噬激活和线粒体蛋白含量增强一致的肌肉蛋白质组学特征相关。这些发现与临床前证据和早期人类研究一致,并支持更大规模的验证试验,以确定 UA 是否可以成为保留肌肉功能的有效干预措施。
Reference
Singh A, D’Amico D, Andreux PA, Fouassier AM, Blanco-Bose W, Evans M, Aebischer P, Auwerx J, Rinsch C. Urolithin A improves muscle strength, exercise performance, and biomarkers of mitochondrial health in a randomized trial in middle-aged adults. Cell Rep Med. 2022 May 17;3(5):100633. doi: 10.1016/j.xcrm.2022.100633 IF: 10.6 Q1 . PMID: 35584623 IF: 10.6 Q1 ; PMCID: PMC9133463 IF: 10.6 Q1 .