亮点
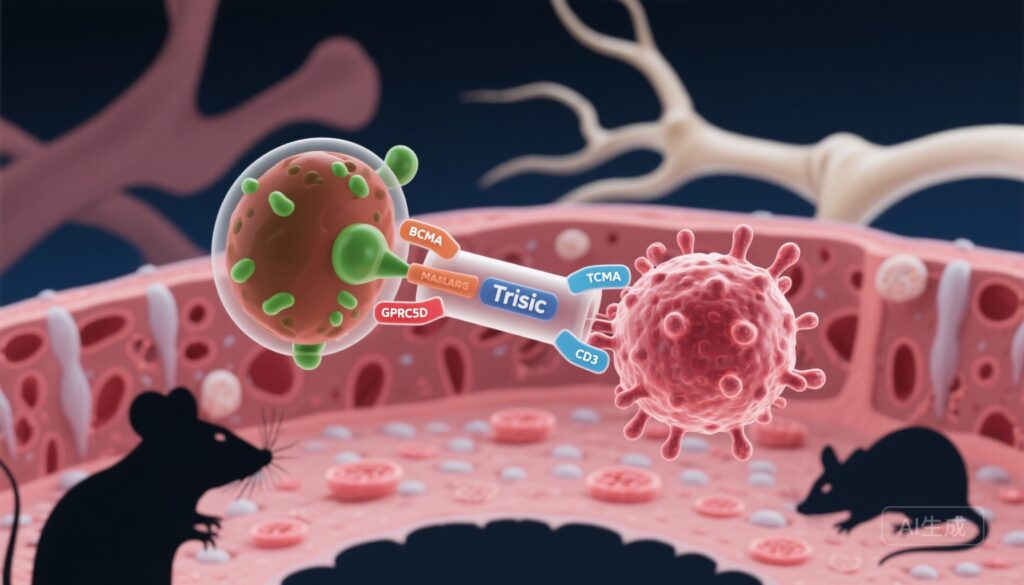
– Ramantamig (JNJ-79635322) 是一种针对BCMA、GPRC5D和CD3的三特异性T细胞接合剂,旨在增加肿瘤结合亲和力并克服多发性骨髓瘤(MM)中的抗原丢失介导的耐药性。
– 在临床前模型中,Ramantamig 在亚纳摩尔浓度下产生强烈的细胞毒性,耗竭了患者的恶性浆细胞,并在小鼠异种移植模型中显示出肿瘤预防和消退活性。
– 这些数据支持临床转化;两项针对复发/难治性MM(NCT05652335, NCT06768489)的1期试验正在进行,以评估安全性、耐受性、药代动力学和早期疗效。
背景与未满足的需求
多发性骨髓瘤是一种骨髓内的浆细胞恶性肿瘤,其特征是克隆增殖、持续的基因组演变和频繁复发,尽管进行了多次治疗。招募内源性T细胞的抗原定向免疫疗法(如双特异性T细胞接合剂和嵌合抗原受体(CAR)T细胞)已经改变了某些患者的结果,特别是那些靶向B细胞成熟抗原(BCMA)的患者。然而,由于肿瘤异质性、抗原下调或丢失以及免疫抑制的骨髓微环境,持久控制仍然具有挑战性。
双靶向方法旨在减轻抗原逃逸并通过亲和力效应增加靶标结合。GPRC5D(G蛋白偶联受体C组5成员D)作为一种补充的骨髓瘤抗原,其在浆细胞上的高表达和与BCMA不同的模式提供了同时靶向的依据。设计用于共结合两个肿瘤抗原和T细胞上的CD3的三特异性构建体旨在增加对恶性浆细胞的选择性,增强细胞毒性效力,并减少肿瘤细胞通过单一抗原丢失而逃逸的机会。
研究设计(临床前概述)
Pillarisetti等人的论文描述了Ramantamig (JNJ-79635322) 的临床前表征,这是一种结合靶细胞上的BCMA和GPRC5D以及T细胞上的CD3的三特异性抗体。评估包括针对工程化和多发性骨髓瘤细胞系的体外细胞毒性试验、T细胞活化试验、使用患者骨髓样本的体外共培养实验、使用健康供血者的全血共培养试验(添加了骨髓瘤细胞),以及在免疫缺陷小鼠异种移植模型中的体内疗效研究,包括预防和消退范式。
主要实验终点包括肿瘤细胞杀伤效力(EC50)、T细胞活化标志物和细胞因子释放、患者来源样本中恶性浆细胞的耗竭,以及小鼠模型中的肿瘤生长抑制和消退。明确测试了该构建体对表达单个或两个抗原的细胞系的活性,以探究双靶向的附加价值。
关键发现
体外效力和T细胞活化
Ramantamig 在亚纳摩尔浓度下对多发性骨髓瘤细胞系产生了强烈且浓度依赖性的细胞毒性,表明其具有高功能效力。三特异性构建体激活了T细胞(活化标志物上调和效应细胞因子产生)并伴随肿瘤细胞裂解。重要的是,Ramantamig 对表达双抗原和单抗原的骨髓瘤细胞均表现出活性,表明该构建体可以在存在BCMA或GPRC5D的情况下介导细胞毒性。
体外耗竭患者恶性浆细胞
在使用多发性骨髓瘤患者的骨髓样本进行的体外T细胞共培养试验中,Ramantamig 产生了剂量依赖性的恶性浆细胞耗竭。在原代材料中减少克隆浆细胞群的能力是一个重要的转化信号,支持该构建体能够与内源性人类T细胞结合并靶向临床上相关的疾病细胞。
全血共培养——生理环境
为了更接近生理环境,作者使用了健康供血者的新鲜全血与H929骨髓瘤细胞共培养。在这些条件下,Ramantamig 也引发了剂量依赖性的肿瘤细胞耗竭,表明在其他血液成分存在下的功能性活性,可能反映了循环中靶标结合和效应功能的某些方面。
体内异种移植模型中的疗效
Ramantamig 在小鼠异种移植模型中显示出强烈的抗肿瘤效果。在使用表达单个靶标的克隆细胞的预防模型中,Ramantamig 防止了肿瘤的建立。在两个消退模型中,三特异性药物诱导了肿瘤缩小,支持其在体内预防和治疗背景下的活性。与其他大多数异种移植研究一样,这些模型采用免疫缺陷小鼠重建人T细胞或依赖过继转移来提供效应细胞;尽管如此,它们为体内抗肿瘤效力提供了重要的概念验证。
抗原覆盖和耐药性考虑
该构建体对表达单个和双抗原的细胞均表现出活性是一个关键的机制观察结果。双靶向增加了识别骨髓内异质克隆群体的机会,并减少了选择压力,有利于那些已下调一个靶标抗原的细胞。这些特性如果在患者中得到证实,可能会转化为更深和更持久的缓解。
安全信号和转化考虑
临床前工作集中在效力和机制上;详细的安全性和毒性评估需要临床数据。尽管如此,仍有一些重要的转化考虑:
- 靶向但非肿瘤效应:BCMA和GPRC5D在浆细胞中富集,但正常浆细胞耗竭是预期的靶向效应。一些研究表明,GPRC5D表达与角化组织(如毛囊和指甲)有关;针对GPRC5D的双特异性药物的临床经验报告了皮肤和指甲异常,这需要监测。
- 细胞因子释放和神经毒性:CD3接合疗法通常会触发细胞因子释放综合征(CRS),并且较少见地引发免疫效应细胞相关神经毒性综合征(ICANS)。这些事件的严重程度和时间取决于剂量、给药途径和构建体特定性质(亲和力和价态),必须在早期临床试验中进行评估。
- T细胞适应性和耗竭:持续的抗肿瘤控制需要持久的T细胞功能。重复或长期的T细胞活化可能导致耗竭;可能需要组合策略或序贯疗法来维持或重新激发效应功能。
- 药代动力学和给药:三特异性分子与双特异性或单克隆抗体相比可能具有不同的药代动力学(PK)特征。最佳给药方案以最大化效力并限制毒性将在1期研究中确定。
专家评论和局限性
Ramantamig 代表了骨髓瘤中抗原靶向范式的合理扩展:通过结合两个不同的肿瘤相关抗原并招募T细胞,三特异性药物旨在提高肿瘤选择性并减少耐药性。呈现的临床前数据集显示,在多个互补试验中具有令人鼓舞的效力,包括患者来源的材料——这是超越仅使用细胞系工作的重要的转化步骤。
然而,缺乏临床数据的重要局限性限制了热情。临床前异种移植模型不能完全再现人类骨髓微环境、免疫调节信号或免疫-肿瘤相互作用的长期动态。安全性无法从效力研究中推断;CD3接合剂通常需要谨慎的剂量递增和CRS缓解策略(如逐步剂量递增、皮质类固醇或IL-6阻断准备)。最后,三特异性药物的制造复杂性和药代动力学行为可能影响可扩展性和临床应用。
临床开发和下一步
临床前数据集支持了在复发/难治性多发性骨髓瘤中启动1期临床试验:NCT05652335 和 NCT06768489。这些研究将确定最大耐受剂量(MTD)或推荐的2期剂量(RP2D),表征安全性(重点是CRS、神经毒性和非肿瘤效应),评估药代动力学和药效学,并提供初步的疗效信号,包括反应率和最小残留病(MRD)评估。
未来的临床问题包括三特异性药物相对于现有的BCMA定向模式(CAR T细胞、双特异性抗体、抗体-药物偶联物)的位置,是否可以挽救在BCMA靶向治疗后复发的患者,以及合理的组合策略,如检查点调节、免疫激动剂或微环境靶向剂是否可以增强持久性。
结论
Ramantamig (JNJ-79635322) 是一种针对BCMA和GPRC5D的三特异性T细胞接合剂,在体外、体外和体内模型中显示出强大的抗骨髓瘤活性。该构建体能够靶向单抗原和双抗原表达的细胞,为解决肿瘤异质性和抗原丢失耐药性提供了机制优势。正在进行的1期试验将是确定安全性、耐受性和临床前优势是否转化为复发/难治性多发性骨髓瘤患者的持久临床反应的关键。
资金来源和ClinicalTrials.gov
该研究由开发组织的调查人员进行,并由公司资源支持,如来源手稿所述。注册的临床试验以评估Ramantamig在复发/难治性骨髓瘤中的效果:NCT05652335 和 NCT06768489。
参考文献
Pillarisetti K, Yang D, Luistro L, Yao J, Smith M, Vulfson P, Testa J Jr, Ponticiello R, Brodeur SR, Heidrich B, Packman K, Singh S, Attar RM, Elsayed YA, Philippar U. Ramantamig (JNJ-79635322),一种新型靶向BCMA、GPRC5D和CD3的T细胞接合三特异性抗体,在多发性骨髓瘤模型中的研究。Blood. 2025年10月16日:blood.2025030027。doi: 10.1182/blood.2025030027。Epub提前出版。PMID: 41100731。



临床实用性与价值评述:
Ramantamig(JNJ-79635322)是一种靶向BCMA和GPRC5D的三特异性T细胞接合剂,目前已在多发性骨髓瘤(MM)的体外和体内前临床研究中展现出强大的抗肿瘤活性。该分子同时靶向两个肿瘤相关抗原(BCMA、GPRC5D)以及T细胞的CD3,具有如下临床潜在价值:
抗原逃逸机制克服:通过双靶向,可以减少因骨髓瘤细胞下调或丢失某一抗原而导致的耐药或复发,理论上有望延长缓解时间、提升应答深度。
多重肿瘤克隆杀伤:可同时作用于表达不同抗原的肿瘤克隆,更好地覆盖MM高度异质的人群。
T细胞介导强效杀伤:体外、全血共培养及异种移植模型均证实其可诱导T细胞依赖的恶性浆细胞清除。
已进入I期临床(NCT05652335, NCT06768489):临床前数据强有力地支撑其在复发/难治MM中的转化,安全性、最大耐受剂量、初步疗效信号即将在患者中验证。
不足与可补充之处:
缺乏临床安全性/有效性数据:当前数据均为前临床,尚无法评估不良事件发生率,尤其是细胞因子释放综合征(CRS)、神经毒性以及GPRC5D相关皮肤副作用,需密切等待即将公开的I期临床数据。
异种移植模型局限:动物实验不能完全模拟人类骨髓微环境、免疫调节机制和MM长期进化,真实疗效和长期随访结局需在临床中证实。
生产与药代动力学障碍:三特异性抗体制造较为复杂,其体内分布、降解与药效持续性相对双特异性或单抗需综合考量,可能影响临床推广。
免疫耐受与T细胞疲劳:长期、多次T细胞激活可能导致效应细胞衰竭,需要考虑与免疫检查点抑制剂、激动剂等联合或序贯策略。
补充建议:
建议文章可进一步探讨三特异性构建体与既有CAR-T、双抗、抗体药物偶联物(ADC)在标准治疗流程中的互补定位,以及在前期BCMA靶向治疗失败的患者群体中的再治疗前景。
期待后续I期试验更多关于生物标志物、最小残留病(MRD)动态、个体化分层应用方面的数据披露。
安全性方面建议补充对已知GPRC5D靶向药物不良反应管理策略的总结经验,对临床医生具有现实参考价值。
小结:
该文综述了Ramantamig在多发性骨髓瘤前临床阶段的积极进展,从机制到初步药效验证都具备创新亮点。三特异性策略代表了肿瘤抗原靶向免疫治疗理念的进一步提升。未来其真实临床价值及不良反应谱,仍有赖于正在进行的临床试验予以阐明。