亮点
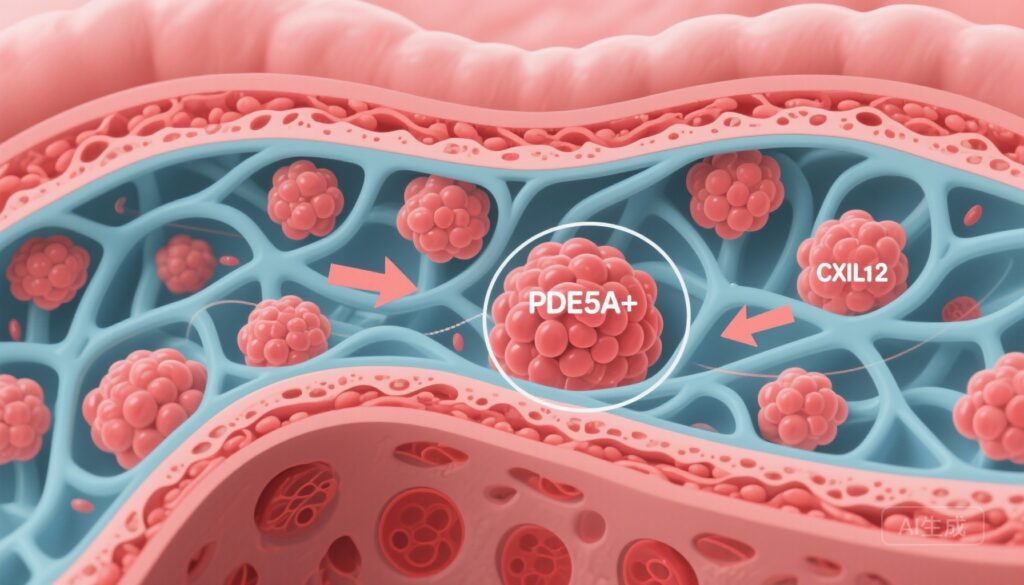
– 在胃癌 (GC) 中,一个独特的 PDE5A+ CAF 亚群与较短的总生存期和免疫排斥的肿瘤微环境 (TME) 相关。
– PDE5A+ CAFs 促进细胞外基质 (ECM) 重塑和上皮-间质转化 (EMT),并通过激活 PI3K/AKT/mTOR 信号通路分泌 CXCL12,招募 CXCR4+ LAG3+ 耗竭 CD8 T 细胞。
– 在临床前模型中,使用伐地那非药理学抑制 PDE5A 并联合 LAG3 阻断显著改善了抗肿瘤免疫并减少了肿瘤生长,支持转化评估。
背景和临床背景
胃癌仍然是全球癌症死亡的主要原因之一。尽管手术、化疗和靶向药物取得了进展,但免疫检查点抑制剂 (ICIs) 的持久获益仅限于部分患者。ICIs 无应答的一个主要决定因素是肿瘤微环境 (TME),其中非恶性基质细胞(尤其是癌症相关成纤维细胞 (CAFs))建立了物理和生化屏障,排除细胞毒性 T 淋巴细胞 (CTLs) 或使免疫细胞偏向功能障碍或抑制状态。识别介导免疫抑制的可操作 CAF 亚群可能为提高 GC 对免疫治疗的敏感性开辟新的联合治疗策略。
研究设计和方法
王等对 24 名胃癌患者的肿瘤样本进行了整合单细胞 RNA 测序 (scRNA-seq),并对病例和对照组的福尔马林固定石蜡包埋 (FFPE) 组织切片进行了空间转录组学分析。这些多模态数据用于绘制细胞组成、定义 CAF 亚群,并将分子特征与临床结果和空间免疫模式关联起来。
关键实验方法包括:识别转录不同的 CAF 簇;将 CAF 特征与总生存期和 CD8+ T 细胞浸润相关联;体外功能测定评估 CAF 对胃癌上皮细胞和基质重塑的影响;研究 CAF 分泌趋化因子的信号通路机制;以及体内小鼠模型测试 PDE5 抑制剂(伐地那非)和 LAG3 免疫检查点阻断的联合疗法。
主要发现
1. PDE5A+ CAF 的发现及其临床关联
通过 scRNA-seq 和空间映射,研究人员识别出一个以高表达磷酸二酯酶 5A (PDE5A) 为特征的可重复 CAF 亚群。PDE5A+ CAF 特征与 GC 患者的较差总生存期和免疫排斥 TME 的组织学特征相关,包括减少的 CD8+ 细胞毒性 T 淋巴细胞进入肿瘤巢和 T 细胞在基质边缘的富集。
2. ECM 重塑和 EMT 促进
PDE5A+ CAFs 表达与细胞外基质 (ECM) 沉积和重塑相关的基因上调。功能上,共培养和条件培养基实验显示,这些 CAFs 促进了 GC 细胞的上皮-间质转化 (EMT) 表型(如增加波形蛋白,减少 E-钙粘蛋白),这可以促进侵袭,并且通过改变组织结构和刚度进一步导致免疫排斥。
3. PI3K/AKT/mTOR 激活和 CXCL12 分泌
机制研究表明,PDE5A+ CAFs 激活 PI3K/AKT/mTOR 信号级联,导致趋化因子 CXCL12 的释放增加。CXCL12 是 CXCR4 表达细胞的强效趋化因子,已被证明在多种实体瘤中参与效应 T 细胞的排除和抑制或耗竭淋巴细胞群体的招募。
4. 耗竭 LAG3+ CD8 T 细胞的招募
空间和表型分析显示,PDE5A+ CAF 区域富含表达耗竭标记物的 CD8+ T 细胞,包括 LAG3 和与终末耗竭 (TEX+) 相容的特征。数据支持一种模型,即 CAF 来源的 CXCL12 与 CD8+ T 细胞上的 CXCR4 结合,促进其在基质区域的滞留并维持或驱动以 LAG3 表达为标志的耗竭表型,从而削弱有效的抗肿瘤反应。
5. 治疗组合:PDE5 抑制加 LAG3 阻断
在胃癌的小鼠模型中,使用伐地那非药理学抑制 PDE5A 减少了 CAF 介导的信号输出并降低了 CXCL12 水平。单独使用伐地那非或 LAG3 阻断产生的抗肿瘤效果有限,但两者的联合使用协同增加了功能性 CD8+ T 细胞的肿瘤内浸润,减少了耗竭 T 细胞表型,并比任一单一药物更有效地抑制了肿瘤生长。
机制解释和生物学合理性
提出的机制整合了基质生物学、趋化因子驱动的白细胞迁移和 T 细胞功能障碍。PDE5A 是环鸟苷酸 (cGMP) 磷酸二酯酶;在 CAFs 中其上调似乎与下游 PI3K/AKT/mTOR 信号通路的激活有关——这一通路已知调节蛋白质合成、分泌表型和细胞存活。通过增加 CXCL12 分泌,PDE5A+ CAFs 生成趋化因子梯度,保留基质中的 CXCR4+ 淋巴细胞,防止有效的 CTL 与恶性上皮细胞接触。持续暴露于这种抑制性基质生态位可能会驱动或维持抑制受体(如 LAG3)的表达,与观察到的 LAG3+ 耗竭 CD8 T 细胞 (TEX+ 表型) 富集一致。同时靶向基质趋化因子轴(通过 PDE5 抑制减少 CXCL12 产生)和介导功能耗竭的检查点(LAG3 阻断)提供了一种合理的双管齐下的方法来重新调整 TME。
转化和临床意义
这项工作中有几个有吸引力的转化元素:首先,伐地那非等 PDE5 抑制剂是口服可用、临床批准的药物,具有已知的药代动力学和安全性特征,可以加速再利用努力。其次,LAG3 阻断在临床上可行——抗 LAG3 抗体 relatlimab 已获得与抗 PD-1 联合使用的黑色素瘤监管批准,使联合策略成为可能。
潜在的临床策略包括在生物标志物选择的 GC 患者中测试伐地那非(或其他 PDE5 抑制剂)与 LAG3 抗体和/或 PD-1 轴抑制剂的联合使用,这些患者的肿瘤显示 PDE5A+ CAF 特征或免疫排斥的空间证据。检测 CAFs 中 PDE5A 表达的空间转录组学或免疫组化面板可以用作伴随诊断,以丰富最有可能受益的患者的试验。
局限性和专家评论
虽然该研究提供了令人信服的多模态证据,但仍需强调几个注意事项。主要的人类发现队列包括 24 名患者——足以进行探索性的 scRNA-seq 但不足以进行明确的临床相关性验证;需要在更大、独立的队列中进行验证。在小鼠模型中展示了临床前疗效,但这些模型可能无法完全重现人类基质的复杂性、免疫谱系或 PDE5 抑制剂的药代动力学。系统性 PDE5 抑制可能对血管张力、免疫细胞和非 CAF 基质成分产生多效性影响;剂量选择和毒性监测将在人类试验中非常重要。
仍有许多机制问题需要解决:CAF 中 PDE5A 诱导的上游调节因子、与其他 CAF 亚型(包括肌成纤维细胞和炎症 CAFs)的潜在相互作用,以及 CAF 靶向对其他免疫抑制细胞群体(如调节性 T 细胞、髓系细胞)的影响程度需要进一步研究。最后,必须仔细评估联合方法的附加毒性和最佳给药时间(同时或序贯给药)。
下一步和研究重点
立即的重点包括:在更大的 GC 队列中验证 PDE5A+ CAF 特征及其预后/预测价值,这些队列与 ICI 相关的结果;使用多重免疫荧光或空间转录组学在不同地理和分子 GC 亚型中进行原位验证;在荷瘤宿主中进行伐地那非的剂量寻找和药效学研究,以定义基质调节;以及早期临床试验,最好是作为生物标志物选择的试验,结合 PDE5 抑制剂与 LAG3 和/或 PD-1 阻断。
结论
王等的工作描述了一个先前未被认识的 PDE5A+ CAF 亚群,该亚群通过 ECM 重塑和 PI3K/AKT/mTOR 依赖的 CXCL12 分泌在胃癌中塑造免疫排斥的 TME,招募耗竭的 LAG3+ CD8 T 细胞。临床前数据显示,伐地那非和 LAG3 阻断的协同作用提供了一种合理且可行的策略来逆转基质介导的免疫抑制。如果在更大的队列和早期临床试验中得到验证,PDE5A 靶向方法可能成为胃癌生物标志物指导的联合免疫治疗的一部分。
参考文献
1. Wang K, Xie CJ, Ding Z, 等. PDE5A+ 癌症相关成纤维细胞增强胃癌中的免疫抑制. Gut. 2025 年 10 月 20 日:gutjnl-2025-335794. doi:10.1136/gutjnl-2025-335794. PMID: 41115748.
2. Kalluri R. 成纤维细胞在癌症中的生物学和功能. Nat Rev Cancer. 2016;16(9):582–598.