亮点
实现指南推荐的低密度脂蛋白胆固醇(LDL-C)水平的ST段抬高型心肌梗死(STEMI)患者中,新生动脉粥样硬化的发生率显著较低(7%),而未达到这些目标的患者则为19%。
多变量分析显示,每增加25 mg/dL的治疗期间LDL-C水平,药物洗脱支架(DES)植入后三年内发生新生动脉粥样硬化的风险增加46%。
光学相干断层扫描(OCT)提供了高分辨率证据,表明系统性脂质控制直接影响支架冠状动脉段的微观环境。
这些发现强化了‘越低越好’的LDL-C假说,将其益处从原生血管斑块稳定扩展到晚期支架失败机制的预防。
背景:晚期支架失败的挑战
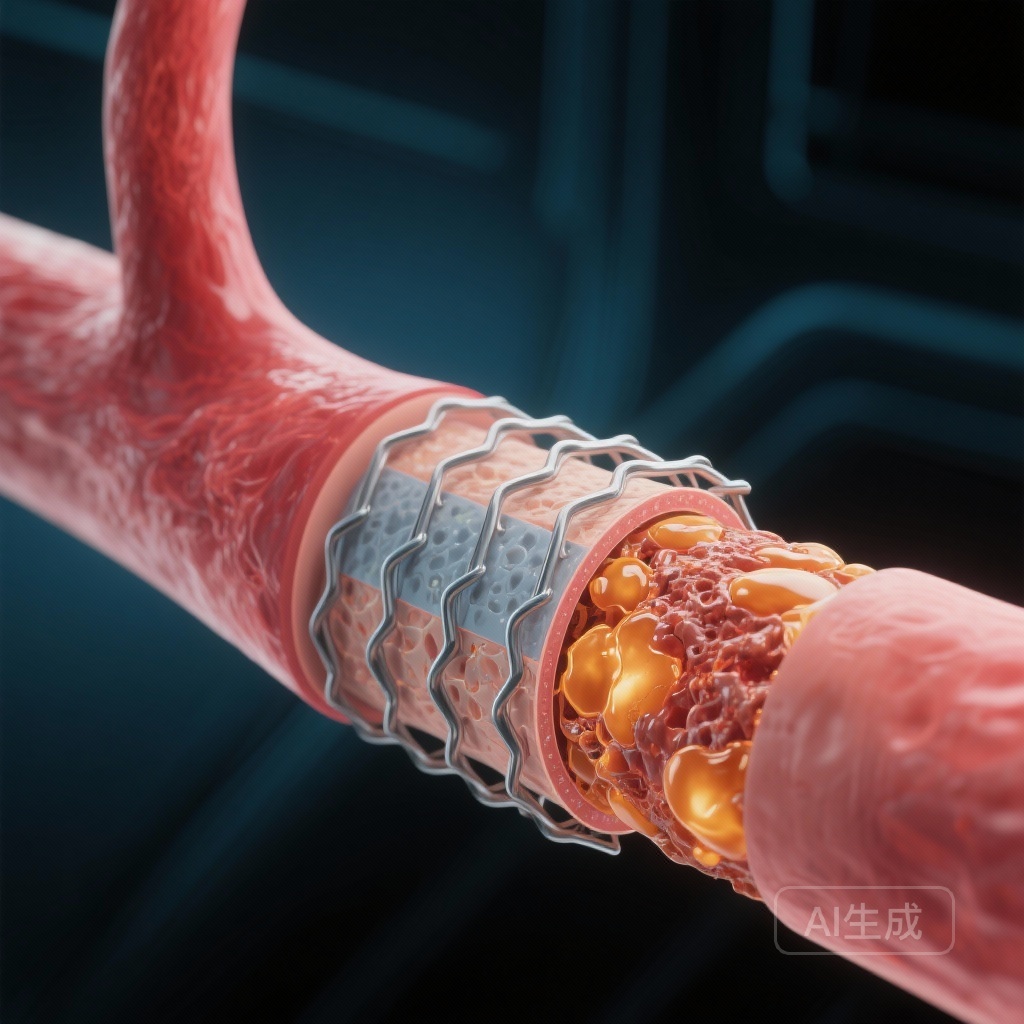
尽管药物洗脱支架(DES)在减少早期再狭窄和靶病变血运重建方面产生了革命性的影响,但支架段的长期管理仍然是一个重要的临床难题。新生动脉粥样硬化——在支架段内膜层内形成新的动脉粥样硬化斑块——已成为晚期和极晚期支架失败的主要驱动因素。与以平滑肌细胞增殖为特征的传统再狭窄不同,新生动脉粥样硬化涉及富含脂质的巨噬细胞浸润、纤维粥样瘤形成,以及可能的斑块破裂和支架内血栓形成。
在ST段抬高型心肌梗死(STEMI)背景下,炎症环境加剧,未来心血管事件的风险升高,二级预防至关重要。虽然低密度脂蛋白胆固醇(LDL-C)与原生冠状动脉疾病进展的关系已得到充分证实,但在现代DES平台中其在新生动脉粥样硬化形成中的具体作用仍不明确。了解这种关系对于优化经皮冠状动脉介入治疗(PCI)后的药物治疗和改善患者的长期预后至关重要。
研究设计和方法
本研究是对CONNECT(比较生物可吸收聚合物和持久聚合物依维莫司洗脱支架之间的新生动脉粥样硬化)随机临床试验的事后分析。该试验在瑞士和日本的七家高容量心脏中心进行,最初在2017年至2020年间随机分配了239名STEMI患者接受主要经皮冠状动脉介入治疗(PCI),使用生物可吸收聚合物或持久聚合物依维莫司洗脱支架。
为了进行二次分析,研究人员重点关注了178名存活至三年并进行了随访光学相干断层扫描(OCT)的患者。OCT被认为是血管内成像的金标准,因其接近组织学的分辨率(10–20 μm),可以精确识别新生动脉粥样硬化的特征,如富含脂质的内膜、巨噬细胞积聚和钙化。
根据是否达到指南推荐的目标LDL-C水平(通常定义为<55 mg/dL或基线值减少≥50%,具体取决于研究时的特定区域指南),将患者分为两组。他汀类药物和其他降脂剂的使用按照标准治疗进行。主要终点是在3年时通过独立核心实验室影像分析评估的新生动脉粥样硬化的发生率。
关键发现:低LDL-C的保护作用
在178名接受评估的患者中,平均年龄为63.4岁,15%为女性。队列分为达到目标LDL-C水平的患者(n = 98, 55%)和未达到目标的患者(n = 80, 45%)。血脂控制的差异显而易见:目标组的平均治疗期间LDL-C水平为48 mg/dL,而非目标组为87 mg/dL。
新生动脉粥样硬化的发生率
结果令人震惊。仅7%的达到目标LDL-C水平的患者检测到新生动脉粥样硬化,而未达到目标的患者为19%。这相当于血脂控制不佳的患者发生新生动脉粥样硬化的风险增加了三倍(比值比 [OR],3.00;95% CI,1.19-8.24;P = .02)。
多变量预测因子分析
为了考虑潜在的混杂因素,研究人员进行了多变量逻辑回归分析。治疗期间LDL-C水平被确定为新生动脉粥样硬化形成的强大且独立的决定因素。具体来说,每增加25 mg/dL的LDL-C,新生动脉粥样硬化的风险增加46%(OR,1.46;95% CI,1.09-2.01;P = .01)。其他因素,如支架类型(生物可吸收聚合物与持久聚合物)或基线患者特征,在3年时对这一特定结局的独立预测能力并不相同。
形态学特征
OCT成像显示,高LDL组的新生动脉粥样硬化病变更可能表现出与斑块不稳定性相关的特征。尽管该研究未设计用于检测晚期支架血栓等罕见临床事件的差异,但非目标组中富含脂质的内膜的高发率提示未来急性冠状动脉综合征的高风险。
专家评论:机制见解和临床意义
CONNECT试验分析的结果为系统代谢健康与局部血管愈合之间提供了重要联系。认为DES中的新生动脉粥样硬化发展速度比裸金属支架更快,因为药物-聚合物涂层可能会延迟功能性内皮化。这种‘渗漏’或功能障碍的内皮允许循环中的LDL-C更容易迁移到内膜的亚内皮空间。
一旦进入内膜,LDL-C会氧化并被巨噬细胞吞噬,导致泡沫细胞形成。由于支架内的内膜是一个相对隔离的环境,剪切应力改变,这一过程可能会比原生动脉粥样硬化发生得快得多——有时在几个月到几年内,而不是几十年。通过维持极低水平的循环LDL-C(接近40-50 mg/dL),临床医生实际上减少了驱动脂质渗透到血管壁的‘压力’或梯度。
从临床角度来看,这项研究强化了‘他汀加’方法的必要性。鉴于本试验中有45%的患者未能达到目标水平,尽管处于受控试验环境中,显然需要更早、更积极地使用非他汀类药物,如依折麦布和PCSK9抑制剂,特别是在高风险的STEMI人群中。我们不能再将支架植入视为解决局部问题的‘修复’;相反,它是一个催化剂,需要更加严格的系统性风险因素管理。
局限性和未来方向
尽管数据令人信服,但仍需注意几个局限性。作为事后分析,该研究并未专门针对新生动脉粥样硬化的终点进行设计。此外,3年的随访时间虽然重要,但可能无法捕捉到新生动脉粥样硬化的完整轨迹,后者在5到10年内持续增加。此外,该队列主要由日本人和瑞士人组成,这可能限制了其对具有不同基线代谢特征的其他种族群体的推广性。
未来的研究应关注超低LDL-C水平(例如<30 mg/dL)不仅能否预防,还能否逆转早期新生动脉粥样硬化的改变。此外,人工智能在OCT分析中的集成可以为更大规模的临床注册研究提供更自动化的标准化评估。
结论
对CONNECT随机临床试验的二次分析提供了强有力的证据,表明治疗期间的LDL-C水平是DES植入后STEMI患者新生动脉粥样硬化的主要驱动因素。实现指南推荐的血脂目标与新发高危斑块的显著减少有关。这些结果强调,积极的降脂治疗不仅是预防原生疾病进展的工具,也是确保冠状动脉支架长期结构和功能完整性的重要要求。
资金和试验信息
CONNECT试验得到了多项学术和临床资助的支持。ClinicalTrials.gov标识符:NCT03440801。数据分析时间为2024年9月至2025年10月。
参考文献
1. Häner JD, Kakizaki R, Taniwaki M, 等. 低密度脂蛋白胆固醇水平与STEMI后的新生动脉粥样硬化:对CONNECT随机临床试验的二次分析. JAMA Cardiol. 2025; 发表在线2025年12月17日. doi:10.1001/jamacardio.2025.4723.
2. Otsuka F, 等. 新生动脉粥样硬化:组织病理学发现及其对支架失败的影响概述. Eur Heart J. 2015;36(32):2147-2159.
3. Mach F, 等. 2019 ESC/EAS血脂异常管理指南:通过脂质修饰降低心血管风险. Eur Heart J. 2020;41(1):111-188.
4. Nakazawa G, 等. 人类冠状动脉植入裸金属和药物洗脱支架的新生动脉粥样硬化的病理. J Am Coll Cardiol. 2011;57(11):1314-1322.