亮点
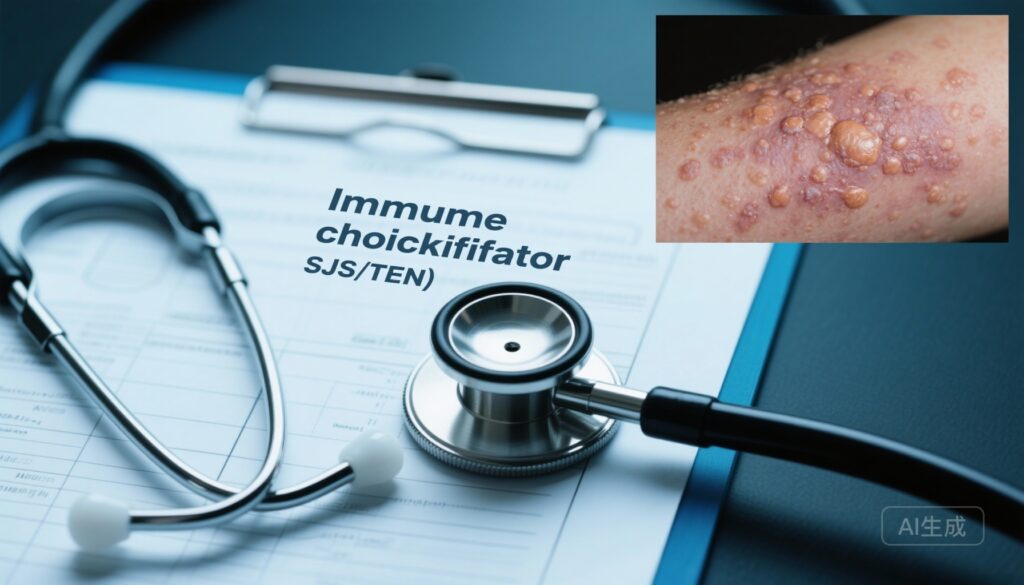
– 2013年至2023年FAERS分析近1400万份报告发现,免疫检查点抑制剂(ICI)暴露独立关联显著更高的Stevens-Johnson综合征/中毒性表皮坏死松解症(SJS/TEN)风险(调整后比值比 [aOR] 9.14;95% CI 8.42–9.93)。
– 与已知的高风险药物(如别嘌醇、磺胺类药物)和ICIs共同暴露显示出加性或超加性相互作用(主要归因比例 [AP] 0.38 对强效诱因;AP 0.52 对弱效诱因),支持双打击模型。
– ICI相关SJS/TEN的发病时间晚于非ICI病例,尤其是PD-1抑制剂,这与肿瘤学护理中的持续免疫激活和诊断挑战一致。
背景
Stevens-Johnson综合征和中毒性表皮坏死松解症(SJS/TEN)是罕见的、危及生命的黏膜皮肤反应,由药物或感染引起的细胞毒性免疫反应驱动。TEN的死亡率仍然很高,幸存者通常有严重的后遗症。针对PD-1、PD-L1、CTLA-4和其他抑制途径的免疫检查点抑制剂(ICIs)通过释放抗肿瘤免疫反应改变了肿瘤学,但也产生了多种免疫相关不良事件(irAEs),包括皮肤病毒性。区分经典的、特定药物的SJS/TEN与ICI相关的SJS/TEN样或苔藓样大疱性皮疹在临床上具有挑战性,且ICIs与其他药物触发因素之间的相互作用尚未完全阐明。随着ICIs在各种肿瘤类型和治疗线中的应用扩大,明确其在SJS/TEN风险、时机和机制中的作用是一项紧迫的临床需求。
研究设计和方法
Mukherjee等人调查了2013年至2023年美国食品药品监督管理局不良事件报告系统(FAERS)中的13,986,839份去重报告,以识别SJS/TEN报告(n=17,495)。作者使用多变量逻辑回归评估ICI暴露与SJS/TEN之间的关联,调整了年龄(样条项)、性别、记录的癌症诊断、多药治疗(同时使用的药物数量)以及对定义的强效(如拉莫三嗪;复方新诺明;苯妥英;别嘌醇;卡马西平)和弱效(某些大环内酯类、氟喹诺酮类、阿昔洛韦)诱因药物的暴露。相互作用指标——交互作用的相对超额风险(RERI)、归因比例(AP)和协同指数——量化了当ICIs与其他诱因共同发生时的加性或超加性风险。潜伏期分析使用了两个Cox比例风险模型:(1) 机制基础模型,根据ICI机制分类主要嫌疑人(PS)药物;(2) 时间依赖模型,动态更新对PD-1/PD-L1、CTLA-4或LAG-3抑制剂的暴露。模型纳入了相同的协变量,并通过插补处理缺失的年龄数据。补充方法中报告了其他分析细节。
关键发现
与SJS/TEN的独立关联:在调整后的分析中,列出任何ICI的报告相比非ICI报告,SJS/TEN的风险显著更高(调整后比值比 [aOR] 9.14;95% CI 8.42–9.93;P < .001)。正如预期的那样,暴露于预定义的强效诱因药物是最强的独立预测因子(aOR 14.31;95% CI 13.77–14.87)。弱效诱因也保留了独立关联(aOR 3.69;95% CI 3.51–3.88)。
与其他药物诱因的协同作用:相互作用分析指出加性或超加性效应。对于同时暴露于ICIs和强效诱因的患者,AP为0.38(95% CI 0.22–0.50),表明共暴露个体中有38%的风险可归因于相互作用。对于ICIs与弱效诱因,AP更高(0.52;95% CI 0.38–0.63),且两类的协同指数均超过1,支持不仅仅是简单的乘法共存。RERI值对两类均为正且显著,与独立效应之外的加性超额风险一致。
潜伏期和时机:潜伏期分析显示,ICI相关的SJS/TEN倾向于比非ICI病例发生得更晚。抗PD-1主要嫌疑人报告的中位时间至事件为27天,而非ICI诱因的中位时间为13天。在时间依赖的Cox模型中,PD-1抑制剂与早期发病的风险较低有关(风险比 [HR] 0.82;95% CI 0.72–0.94;P = .004),与延迟表现一致。机制基础模型同样显示,PD-1抑制剂的发病时间晚于非ICI药物(HR 0.71;95% CI 0.60–0.94;P < .001)。癌症诊断本身与风险呈负相关(aOR 0.60;95% CI 0.58–0.63),并与早期发病有关(HR ≈ 0.78 在两个模型中),可能反映了肿瘤学人群中的报告或诊断复杂性。
其他观察和数据质量信号:一些分析结果揭示了报告的人为因素:缺少或插补的年龄报告的比值比有显著差异;“未指定性别”类别与SJS/TEN的关联异常高,可能反映了严重不良事件报告完整性的变化。每单位增加的伴随药物数量的aOR略小于1,这是一个意外的方向,可能反映了共线性、报告阈值或适应症混杂。
解释和机制可信度
这些结果加强了ICIs是SJS/TEN风险独立驱动因素的信号,并建议它们可能与特定药物的免疫触发因素产生协同作用。从机制上讲,经典SJS/TEN是一个CD8+ T细胞介导的细胞毒性过程,在许多情况下依赖于HLA限制的药物衍生抗原的呈现(例如,HLA-B*58:01 和别嘌醇诱导的严重皮肤不良反应)。ICIs解除T细胞上的抑制检查点,降低活化阈值,可能使预先存在或新启动的药物特异性T细胞扩增和发挥效应功能。这一模型符合双打击假说:(1) 高风险药物提供HLA限制的抗原刺激;(2) ICI放大细胞毒性T细胞反应,增加暴发性黏膜皮肤损伤的可能性。PD-1抑制剂的延迟发病可能反映了持续的T细胞活化、较慢的表位扩散、逐渐招募组织驻留记忆T细胞或其他不同于快速作用的小分子过敏反应的免疫动力学。
临床意义
对于肿瘤学家、皮肤科医生和急性护理团队,该研究提供了几个可操作的要点:
- 治疗前药物核对:仔细审查并在可行的情况下避免在ICI启动前后短时间内开始或继续使用高风险药物(如别嘌醇、磺胺类药物、芳香族抗惊厥药)。对于有已知HLA关联的药物(如别嘌醇和HLA-B*58:01),遵循现有的药物基因组学指导(在高风险人群中开始别嘌醇前进行HLA-B*58:01检测)。
- 对延迟反应的高度警惕:延长ICI暴露后对严重皮肤反应的监测窗口,特别是对于抗PD-1药物。在肿瘤学诊所中,教育患者和输液护士报告黏膜症状、水疱或迅速蔓延的皮肤病变,即使在开始治疗数周后也是如此。
- 诊断谨慎和早期专科参与:区分真正的SJS/TEN与ICI相关的苔藓样或大疱性皮疹,因为管理策略和预后可能不同。早期皮肤科咨询和必要时考虑皮肤活检,以及烧伤科转诊,仍然是必不可少的。
- 联合用药决策:如果存在替代方案(例如,用低风险药物替代预防或感染治疗药物),在患者特定风险允许的情况下,考虑避免同时使用氟喹诺酮/大环内酯类或其他相关药物与ICIs。
治疗:ICI相关SJS/TEN的管理与一般SJS/TEN原则一致——立即停用可疑致病药物、支持性护理、多学科管理,并考虑全身免疫调节治疗。关于检查点阻断相关SJS/TEN是否对特定免疫疗法(如全身糖皮质激素、环孢素、静脉注射免疫球蛋白)有不同的反应,数据有限。必须在癌症控制和感染风险之间平衡免疫抑制;决策应个体化。
优势和局限性
该研究的优势包括非常大的药物警戒数据、仔细的多变量建模、使用相互作用指标量化加性风险,以及潜伏期的双重建模(机制基础和时间依赖)。这些发现具有生物学合理性,并在不同分析方法中一致。
然而,解释必须考虑到FAERS的局限性:漏报、报告质量不一、安全信号后的刺激性报告、无法确认暴露时间、无法确认临床诊断、缺乏分母数据(发病率),以及潜在的适应症混杂。记录的癌症与SJS/TEN风险的负相关很可能反映了报告或记录模式,而不是保护性的生物效应。一些分析结果(如未指定性别、每种药物的小保护效应)突显了数据完整性问题。自发报告中不能确定因果关系;需要前瞻性注册研究和对照观察研究。
研究和实践优先事项
当前的优先事项包括:
- 前瞻性药物警戒和注册研究,准确捕获时间、剂量、活检确诊诊断和结果,以估计发病率和归因风险。
- 药物基因组学研究,以识别预测ICI相关SJS/TEN或增强与特定药物相互作用的HLA标志物和其他宿主因素。
- 机制转化研究(T细胞受体库、单细胞谱型、抗原提呈试验),以证明ICIs是否扩展药物特异性细胞毒性克隆或以其他方式调节致病途径。
- 临床指南,涉及联合用药实践、ICI启动后的监测窗口,以及疑似ICI相关SJS/TEN的标准化管理路径。
结论
这项全面的FAERS分析提供了强有力的药物警戒证据,表明免疫检查点抑制剂独立关联SJS/TEN报告增加,与已知的诱因药物共同暴露显著放大风险,符合双打击、T细胞介导的模型。PD-1抑制剂的观察到的延迟发病给肿瘤学护理带来了诊断挑战。临床医生应优先进行药物核对、患者教育和早期皮肤科参与,研究人员应追求前瞻性、机制性和药物基因组学研究,以指导癌症免疫治疗时代的更安全用药和风险分层。
资金和试验注册
主要研究是对FAERS数据的药物警戒分析。总结中未提供临床试验或行业资助声明。有关试验标识符或资金详情,请参阅原始出版物:Mukherjee等,《JAMA肿瘤学》(2025年)。
参考文献
1. Mukherjee M, Park D, Asiaee A, et al. Immune Checkpoint Inhibitors as Independent and Synergistic Drivers of SJS/TEN. JAMA Oncol. 2025 Oct 30. doi:10.1001/jamaoncol.2025.4349. PMID: 41165703.
2. Postow MA, Sidlow R, Hellmann MD. Immune-related adverse events associated with immune checkpoint blockade. N Engl J Med. 2018 Jan 11;378(2):158-168. doi:10.1056/NEJMra1703481.
3. Hung SI, Chung WH, Liou LB, et al. HLA-B*5801 allele as a genetic marker for severe cutaneous adverse reactions caused by allopurinol. N Engl J Med. 2005 Nov 10;353(11):1125-1131. doi:10.1056/NEJMoa051961.
4. Roujeau JC, Stern RS. Severe adverse cutaneous reactions to drugs. N Engl J Med. 1994 Nov 10;331(19):1272-1285. doi:10.1056/NEJM199411103311907.
文章缩略图的AI图像提示
临床、高细节插图:一位担忧的肿瘤学家和皮肤科医生在明亮的诊室里查看患者病历;前景是一只前臂上的水疱性皮疹特写和一张打开的药物清单,显示“免疫检查点抑制剂”和“别嘌醇”;冷蓝色和中性色调,照片级真实感,柔和的戏剧性灯光,聚焦于面部和皮疹,3:2宽高比。