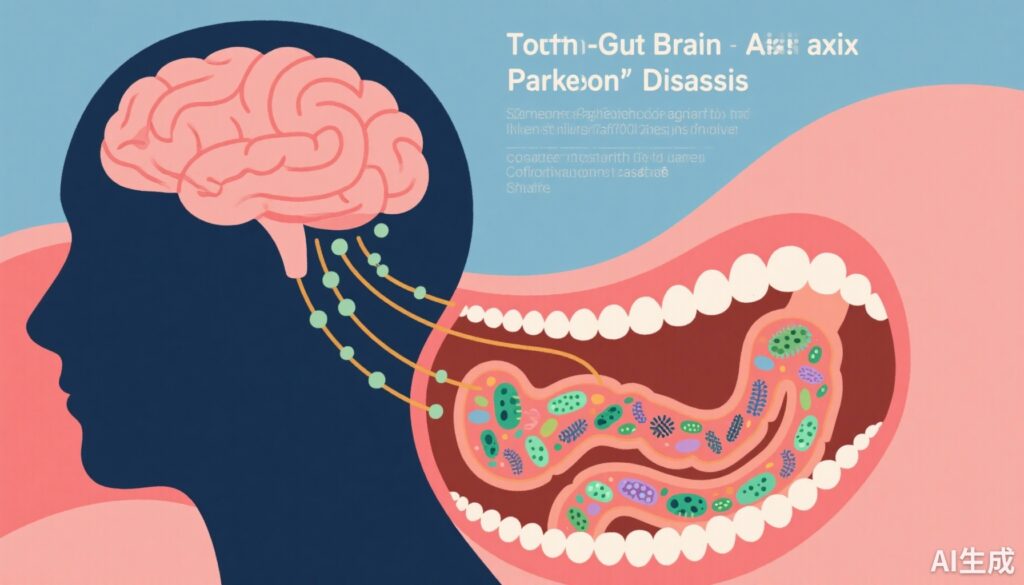
亮点
– 口腔和肠道微生物组的致病因子与帕金森病(PD)中认知障碍的进展有关。
– 口腔-肠道移位增加了致病性,破坏了宿主免疫和脑内皮功能。
– 整合宏基因组学和唾液元蛋白质组学揭示了PD轻度认知障碍(PD-MCI)和痴呆(PDD)中的微生物功能失调。
– 研究结果支持口腔-肠道-大脑轴作为神经退行性疾病生物标志物和治疗干预的有希望目标。
研究背景与疾病负担
帕金森病(PD)影响全球超过1000万人,是一种主要的神经退行性疾病,以运动症状为主。然而,非运动症状,尤其是认知障碍(CI),在大多数PD患者中普遍存在,从轻度认知障碍(PD-MCI)到痴呆(PDD)。PD中CI发展的病理生理机制尚不完全清楚,给早期诊断和靶向干预带来了重大挑战。
人类微生物组已成为通过肠道-大脑轴影响神经健康的关键因素。尽管肠道微生物群在神经退行性疾病中的作用受到了广泛关注,但口腔微生物组及其与肠道微生物组的相互作用——称为口腔-肠道趋向性——尽管口腔是微生物的重要储存库,能够移位至肠道,但相对被忽视。涉及病原生物和致病因子的生态失调可能引发系统性炎症、免疫失调和血脑屏障(BBB)功能障碍,导致神经退行性和认知功能下降。因此,探索口腔-肠道-大脑轴为驱动PD中CI的机制提供了新的视角,并确定了生物标志物发现和治疗靶点的新机会。
研究设计
Clasen等人的这项研究采用了一种全面的多组学方法,包括从根据认知状态(PD-MCI和PDD)分层的PD患者和健康对照组收集的228个肠道和口腔微生物组的宏基因组样本。口腔和肠道微生物群落的分类组成、功能基因途径和致病特征进行了表征。同时,整合了唾液元蛋白质组学以评估微生物蛋白表达及其对宿主免疫和脑内皮细胞功能的影响。
该研究设计允许跨认知障碍谱阶段进行比较,以识别与疾病进展相关的微生物变化。主要研究终点包括识别与PD相关认知功能下降相关的微生物分类群、致病因子、失调的代谢途径和宿主-微生物组相互作用特征。
关键发现
微生物组成和致病因子: 在PD患者和对照组之间观察到口腔和肠道微生物组的显著差异,特别是在认知障碍患者中。潜在致病性的微生物物种(病原生物)在PD-MCI患者中显著丰富,而在PDD患者中更为显著。值得注意的是,几种源自口腔的微生物在肠道中的丰度增加,表明了口腔-肠道移位——一种可能增强致病潜力的机制。
致病因子,如粘附分子、毒素和免疫逃避蛋白,其丰度随认知功能下降严重程度的增加而增加。这丰富了微生物致病性不仅限于简单的生态失调,而是积极参与PD发病机制的概念。
功能失调: 识别出与碳水化合物代谢、氨基酸代谢和神经活性化合物生物合成相关的失调代谢途径,在PDD中表现出更明显的改变。这些途径可能影响神经炎症和神经退行性过程。
宿主-微生物组相互作用: 与唾液元蛋白质组学的整合显示,升高的微生物致病特征与宿主蛋白变化一致,后者表明免疫受损和血脑屏障内皮功能障碍。这表明口腔-肠道微生物可能对脑内皮细胞产生直接影响,促进血管通透性并促进与PD认知功能下降相关的神经炎症级联反应。
此外,该研究提出的口腔-肠道-大脑轴模型强调了一个动态相互作用,其中口腔病原生物移位至肠道,改变微生物生态和致病性,并影响宿主的系统性和神经环境。
专家评论
本研究在理解PD相关认知功能下降方面取得了显著进展,扩大了关注范围,从传统的肠道-大脑轴扩展到包括口腔微生物组和口腔-肠道移位途径。多组学整合加强了微生物致病因子通过免疫失调和内皮功能障碍机械性地参与神经退行性和CI发展的生物学可信度。这些见解挑战了微生物组参与是被动的观点,并建议针对微生物或微生物组调节的策略可以修改疾病进展。
局限性包括观察性设计无法推断因果关系,以及抗PD药物、饮食和口腔卫生的潜在混杂因素。未来需要纵向队列和机制实验模型来验证这些发现,剖析因果途径,并将生物标志物候选物转化为临床实践。
结论
总之,口腔和肠道微生物组是PD神经退行性过程中的重要组成部分,特别是通过增加致病因子表达和口腔-肠道微生物移位影响认知功能下降。本研究突显了口腔-肠道-大脑轴作为阐明PD病理生理学、开发认知障碍早期生物标志物和设计微生物组靶向治疗的有希望领域。临床医生应了解微生物组对PD非运动症状的多维贡献,正在进行的研究应将口腔健康和微生物组评估整合到PD管理中。
参考文献
- Clasen F, Yildirim S, Arıkan M, et al. Microbiome signatures of virulence in the oral-gut-brain axis influence Parkinson’s disease and cognitive decline pathophysiology. Gut Microbes. 2025 Dec;17(1):2506843. doi: 10.1080/19490976.2025.2506843.
- Braak H, Del Tredici K. Neuroanatomy and pathology of sporadic Parkinson’s disease. Adv Anat Embryol Cell Biol. 2009;201:1-119.
- Mulak A, Bonaz B. Brain-gut-microbiota axis in Parkinson’s disease. World J Gastroenterol. 2015 Aug 14;21(37):10609-20.
- Heintz-Buschart A, Wilmes P. Human gut microbiome: function matters. Trends Microbiol. 2018 Jul;26(7):563-574.
- Needham BD, Trent MS. Fortifying the barrier: the impact of lipopolysaccharide modification on bacterial pathogenesis. Nat Rev Microbiol. 2013 Jul;11(7):467-81.